
Vlastnosti anhydridů, způsob jejich vzniku a aplikace
The anhydridy Jsou to chemické sloučeniny, které vznikají spojením dvou molekul uvolňováním vody. Lze jej tedy považovat za dehydrataci původních látek; i když to není úplně pravda.
V organické a anorganické chemii se o nich zmiňuje a v obou odvětvích se jejich porozumění do značné míry liší. Například v anorganické chemii jsou bazické a kyselé oxidy považovány za anhydridy jejich hydroxidů a kyselin, protože první reagují s vodou za vzniku druhé..
Zde může dojít k záměně mezi pojmy „bezvodý“ a „anhydrid“. Obecně se bezvodý týká sloučeniny, na kterou byl dehydratován beze změn své chemické povahy (neprobíhá žádná reakce); zatímco u anhydridu dochází k chemické změně, která se odráží v molekulární struktuře.
Pokud jsou hydroxidy a kyseliny porovnány s jejich odpovídajícími oxidy (nebo anhydridy), je zřejmé, že došlo k reakci. Na druhé straně mohou být některé oxidy nebo soli hydratovány, ztrácet vodu a zůstat stejnými sloučeninami; ale bez vody, to znamená bezvodý.
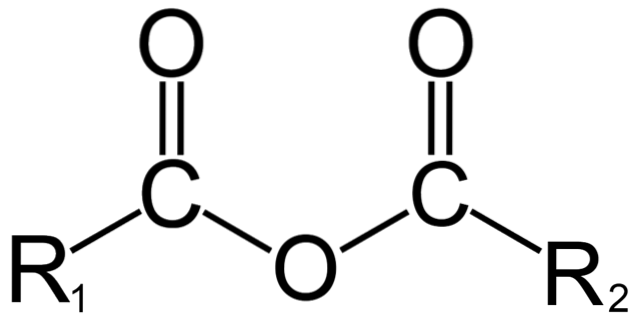
V organické chemii je naopak anhydridem počáteční definice. Například jedním z nejznámějších anhydridů jsou ty, které jsou odvozeny od karboxylových kyselin (horní obrázek). Skládají se ze spojení dvou acylových skupin (-RCO) přes atom kyslíku.
Ve své obecné struktuře je označen R1 pro acylovou skupinu a Rdva pro druhou acylovou skupinu. Protože R1 a R.dva jsou různé, pocházejí z různých karboxylových kyselin a pak jde o anhydrid kyseliny asymetrické. Jsou-li oba substituenty R (ať už aromatické nebo ne) stejné, mluvíme v takovém případě o anhydridu symetrické kyseliny.
Když se dvě karboxylové kyseliny vážou za vzniku anhydridu, může, ale nemusí se tvořit voda, stejně jako další sloučeniny. Vše bude záviset na struktuře těchto kyselin.
Rejstřík článků
- 1 Vlastnosti anhydridů
- 1.1 Chemické reakce
- 2 Jak se tvoří anhydridy?
- 2.1 Cyklické anhydridy
- 3 Názvosloví
- 4 Aplikace
- 4.1 Organické anhydridy
- 5 příkladů
- 5.1 Anhydrid kyseliny jantarové
- 5.2 Anhydrid kyseliny glutarové
- 6 Reference
Vlastnosti anhydridů
Vlastnosti anhydridů budou záviset na tom, na které z nich odkazujete. Téměř všichni mají společné to, že reagují s vodou. U takzvaných bazických anhydridů v anorganických skupinách je však ve skutečnosti několik z nich dokonce nerozpustných ve vodě (MgO), takže toto tvrzení se zaměří na anhydridy karboxylových kyselin.
Teploty tání a bodu varu spadají na molekulární strukturu a intermolekulární interakce pro (RCO)dvaNebo se jedná o obecný chemický vzorec těchto organických sloučenin.
Pokud je molekulová hmotnost (RCO)dvaNebo je nízká, pravděpodobně bezbarvá kapalina při pokojové teplotě a tlaku. Například anhydrid kyseliny octové (nebo anhydrid kyseliny ethanové), (CH3CO)dvaNebo je to kapalina a kapalina s největším průmyslovým významem, jejíž výroba je velmi rozsáhlá..
Reakci mezi anhydridem kyseliny octové a vodou představuje následující chemická rovnice:
(CH3CO)dvaO + HdvaO => 2CH3COOH
Všimněte si, že když se přidá molekula vody, uvolní se dvě molekuly kyseliny octové. K reverzní reakci však u kyseliny octové nemůže dojít:
2CH3COOH => (CH3CO)dvaO + HdvaO (nedochází)
Je nutné uchýlit se k jiné syntetické cestě. Naproti tomu dikarboxylové kyseliny to mohou dělat zahříváním; ale to bude vysvětleno v další části.
Chemické reakce
Hydrolýza
Jednou z nejjednodušších reakcí anhydridů je jejich hydrolýza, která byla právě prokázána pro anhydrid kyseliny octové. Kromě tohoto příkladu existuje anhydrid kyseliny sírové:
HdvaSdvaNEBO7 + HdvaNEBO <=> 2HdvaSW4
Zde máte anhydrid anorganické kyseliny. Všimněte si, že pro HdvaSdvaNEBO7 (také nazývaná kyselina disulfurová), reakce je reverzibilní, takže zahřívání HdvaSW4 koncentrát vede k tvorbě jeho anhydridu. Pokud naopak jde o zředěný roztok HdvaSW4, Vydáno SO3, anhydrid kyseliny sírové.
Esterifikace
Anhydridy kyselin reagují s alkoholy, přičemž mezi nimi je pyridin, za vzniku esteru a karboxylové kyseliny. Zvažte například reakci mezi anhydridem kyseliny octové a ethanolem:
(CH3CO)dvaO + CH3CHdvaOH => CH3COdvaCHdvaCH3 + CH3COOH
Tak se vytvoří ester ethyl-ethanoát, CH3COdvaCHdvaCH3, a kyselina ethanová (kyselina octová).
Prakticky se stane substituce vodíku hydroxylové skupiny acylovou skupinou:
R1-OH => R1-OCORdva
V případě (CH3CO)dvaNebo jeho acylová skupina je -COCH3. Proto se o skupině OH říká, že prochází acylací. Acylace a esterifikace však nejsou zaměnitelné pojmy; acylace může nastat přímo na aromatickém kruhu, známém jako Friedel-Craftsova acylace.
Alkoholy v přítomnosti anhydridů kyselin jsou tedy esterifikovány acylací.
Na druhou stranu pouze jedna ze dvou acylových skupin reaguje s alkoholem, druhá zůstává s vodíkem a tvoří karboxylovou kyselinu; to pro případ (CH3CO)dvaNebo je kyselina ethanová.
Amidace
Anhydridy kyselin reagují s amoniakem nebo aminy (primárními a sekundárními) za vzniku amidů. Reakce je velmi podobná právě popsané esterifikaci, ale ROH je nahrazen aminem; například sekundární amin, RdvaNH.
Opět platí, že reakce mezi (CH3CO)dvaO a diethylamin, EtdvaNH:
(CH3CO)dvaO + 2EtdvaNH => CH3CONEtdva + CH3VRKAT- +NHdvaEtdva
A diethylacetamid, CH3CONEtdva, a karboxylovanou sůl amonného, CH3VRKAT- +NHdvaEtdva.
I když se může rovnice zdát trochu obtížně pochopitelná, stačí se podívat na to, jak skupina -COCH3 nahraďte H EtdvaNH za vzniku amidu:
EtdvaNH => EtdvaNCOCH3
Spíše než amidací je reakcí stále acylace. Vše je shrnuto do tohoto slova; tentokrát prochází acylací amin, nikoli alkohol.
Jak se tvoří anhydridy?
Anorganické anhydridy se tvoří reakcí prvku s kyslíkem. Pokud je tedy prvek kovový, vytvoří se oxid kovu nebo zásaditý anhydrid; a pokud je nekovový, vytvoří se nekovový oxid nebo anhydrid kyseliny.
U organických anhydridů je reakce odlišná. Dvě karboxylové kyseliny se nemohou spojit přímo, aby uvolnily vodu a vytvořily anhydrid kyseliny; je nutná účast sloučeniny, která dosud nebyla zmíněna: acylchlorid, RCOCl.
Karboxylová kyselina reaguje s acylchloridem za vzniku příslušného anhydridu a chlorovodíku:
R1COCl + RdvaCOOH => (R.1CO) NEBO (CORdva) + HCl
CH3COCl + CH3COOH => (CH3CO)dvaO + HCl
A CH3 pochází z acetylové skupiny, CH3CO- a druhý je již přítomen v kyselině octové. Volba konkrétního acylchloridu, stejně jako karboxylové kyseliny, může vést k syntéze anhydridu symetrické nebo asymetrické kyseliny.
Cyklické anhydridy
Na rozdíl od jiných karboxylových kyselin, které vyžadují acylchlorid, mohou dikarboxylové kyseliny kondenzovat na odpovídající anhydrid. K tomu je nutné je zahřát, aby se podpořilo uvolňování HdvaO. Například je ukázána tvorba anhydridu kyseliny ftalové z kyseliny ftalové.

Všimněte si, jak je pětiúhelníkový kruh dokončen a kyslík, který spojuje obě C = O skupiny, je jeho součástí; jedná se o cyklický anhydrid. Podobně lze ocenit, že anhydrid kyseliny ftalové je symetrický anhydrid, protože oba R1 jako R.dva jsou identické: aromatický kruh.
Ne všechny dikarboxylové kyseliny jsou schopné tvořit svůj anhydrid, protože když jsou jejich COOH skupiny široce odděleny, jsou nuceny dokončit větší a větší kruhy. Největší prsten, který lze vytvořit, je šestihranný, větší, než jaký reakce neprobíhá.
Nomenklatura
Jak se jmenují anhydridy? Když vynecháme anorganické, vztahující se k problémům s oxidy, názvy dosud vysvětlených organických anhydridů závisí na identitě R1 a R.dva; tj. z jeho acylových skupin.
Pokud jsou dvě R stejná, jednoduše nahraďte slovo „kyselina“ výrazem „anhydrid“ v příslušném názvu karboxylové kyseliny. A pokud se naopak obě R liší, jsou pojmenovány v abecedním pořadí. Proto, abyste věděli, jak to nazvat, musíte nejprve zjistit, zda jde o anhydrid symetrické nebo asymetrické kyseliny.
CH3CO)dvaO je symetrické, protože R1= R.dva = CH3. Je odvozen od kyseliny octové nebo ethanové, takže se po předchozím vysvětlení jmenuje: anhydrid kyseliny octové nebo ethanové. Totéž se děje s právě zmíněným anhydridem kyseliny ftalové.
Předpokládejme, že máme následující anhydrid:
CH3CO (O) COCHdvaCHdvaCHdvaCHdvaCHdvaCH3
Acetylová skupina vlevo pochází z kyseliny octové a ta vpravo pochází z kyseliny heptanové. Chcete-li pojmenovat tento anhydrid, musíte pojmenovat jeho R skupiny v abecedním pořadí. Jmenuje se tedy: anhydrid kyseliny heptanové octové.
Aplikace
Anorganické anhydridy mají nekonečné využití, od syntézy a přípravy materiálů, keramiky, katalyzátorů, cementů, elektrod, hnojiv atd., Až po potah zemské kůry s tisíci minerálů železa a hliníku a oxidem uhlíku vydechovaným žijící organismy.
Představují výchozí zdroj, bod, kde je odvozeno mnoho sloučenin používaných v anorganických syntézách. Jedním z nejdůležitějších anhydridů je oxid uhličitý, COdva. Je spolu s vodou nezbytný pro fotosyntézu. A na průmyslové úrovni SO3 Je to nezbytné, protože z něj se získává žalovaná kyselina sírová.
Snad nejvíce používaný anhydrid (i když existuje život) je ten, který pochází z kyseliny fosforečné: adenosintrifosfát, lépe známý jako ATP, přítomný v DNA a „energetická měna“ metabolismu..
Organické anhydridy
Anhydridy kyselin reagují acylací, buď na alkohol, za vzniku esteru, aminu za vzniku amidu nebo aromatického kruhu.
Každá z těchto sloučenin obsahuje miliony a stovky tisíc možností karboxylové kyseliny připravit anhydrid; proto syntetické možnosti dramaticky rostou.
Jednou z hlavních aplikací je tedy začlenění acylové skupiny do sloučeniny nahrazením jednoho z atomů nebo skupin její struktury..
Každý samostatný anhydrid má své vlastní aplikace, ale obecně všechny reagují podobným způsobem. Z tohoto důvodu se tyto typy sloučenin používají k modifikaci polymerních struktur a vytváření nových polymerů; tj. kopolymery, pryskyřice, potahy atd..
Například anhydrid kyseliny octové se používá k acetylaci všech skupin OH v celulóze (spodní obrázek). Tím je každý H z OH nahrazen acetylovou skupinou, COCH3.
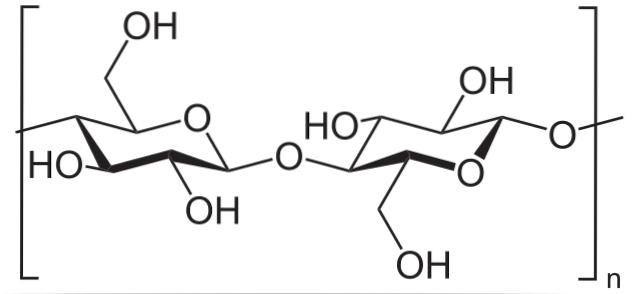
Tímto způsobem se získá polymer acetátu celulózy. Stejnou reakci lze nastínit s jinými polymerními strukturami s NH skupinamidva, také náchylné k acylaci.
Tyto acylační reakce jsou také užitečné pro syntézu léčiv, jako je aspirin (kyselina acetylsalicylová).
Příklady
Ukázalo se, že některé další příklady organických anhydridů končí. I když o nich nebude zmínka, atomy kyslíku mohou být nahrazeny sírou, čímž se získá síra nebo dokonce anhydridy fosforu..
-C6H5CO (O) COC6H5: anhydrid kyseliny benzoové. Skupina C6H5 znamená benzenový kruh. Jeho hydrolýzou vznikají dvě kyseliny benzoové.
-HCO (O) COH: anhydrid kyseliny mravenčí. Jeho hydrolýza produkuje dvě kyseliny mravenčí.
- C6H5CO (O) COCHdvaCH3: anhydrid kyseliny benzoové propanové. Jeho hydrolýzou vznikají kyseliny benzoové a propanové.
-C6HjedenáctCO (O) COC6Hjedenáct: anhydrid cyklohexankarboxylové kyseliny. Na rozdíl od aromatických kruhů jsou nasycené, bez dvojných vazeb.
-CH3CHdvaCHdvaCO (O) COCHdvaCH3: anhydrid kyseliny propanové butanové.
Anhydrid kyseliny jantarové

Zde máte další cyklické deriváty kyseliny jantarové, dikarboxylové kyseliny. Všimněte si, jak tři atomy kyslíku odhalují chemickou povahu tohoto typu sloučeniny.
Anhydrid kyseliny maleinové je velmi podobný anhydridu kyseliny jantarové, s tím rozdílem, že mezi uhlíky, které tvoří základ pětiúhelníku, existuje dvojná vazba..
Anhydrid kyseliny glutarové
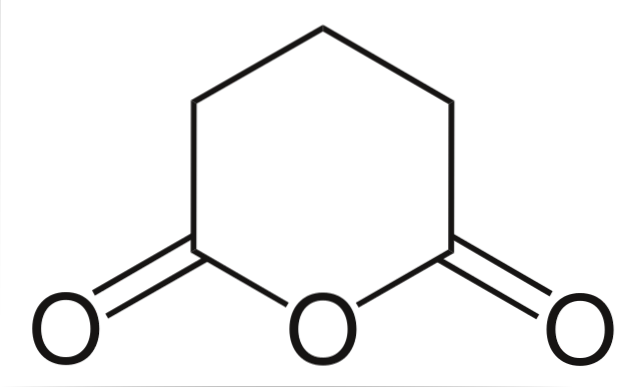
A nakonec je uveden anhydrid kyseliny glutarové. Tím se strukturálně odlišuje od všech ostatních tím, že se skládá ze šestiúhelníkového kruhu. Ve struktuře opět vynikají tři atomy kyslíku.
Jiné anhydridy, složitější, lze vždy prokázat třemi atomy kyslíku velmi blízko u sebe.
Reference
- Redaktoři Encyclopaedia Britannica. (2019). Anhydrid. Enclyclopaedia Britannica. Obnoveno z: britannica.com
- Helmenstine, Anne Marie, Ph.D. (8. ledna 2019). Definice anhydridu kyseliny v chemii. Obnoveno z: thoughtco.com
- Chemistry LibreTexts. (s.f.). Anhydridy. Obnoveno z: chem.libretexts.org
- Graham Solomons T.W., Craig B.Fryhle. (2011). Organická chemie. Miny. (10th edice.). Wiley plus.
- Carey F. (2008). Organická chemie. (Šesté vydání). Mc Graw Hill.
- Whitten, Davis, Peck a Stanley. (2008). Chemie. (8. vydání). Učení CENGAGE.
- Morrison a Boyd. (1987). Organická chemie. (Páté vydání). Addison-Wesley Iberoamericana.
- Wikipedia. (2019). Anhydrid kyseliny organické. Obnoveno z: en.wikipedia.org

Zatím žádné komentáře