
Historie, struktura, vlastnosti, použití a rizika antimonu
The antimon Je to lesklý, stříbrný metalloid s určitým namodralým odstínem. Jeho pevná látka se vyznačuje také velmi křehkou a šupinatou strukturou. Patří do skupiny 15 periodické tabulky v čele s dusíkem. Po vizmutu (a moscoviu) je to nejtěžší prvek skupiny.
Je reprezentován chemickým symbolem Sb. V přírodě se vyskytuje hlavně ve stibitových a ullmannitových minerálních rudách, jejichž chemické vzorce jsou SbdvaS3 respektive NiSbS. Jeho vysoká tendence k tvorbě sulfidů místo oxidů je způsobena jeho chemicky měkkou.

Na druhé straně je antimon také fyzicky měkký, s tvrdostí 3 podle Mohsovy stupnice. Je stabilní při pokojové teplotě a nereaguje s kyslíkem ve vzduchu. Ale když se zahřívá v přítomnosti kyslíku, vytváří oxid antimonitý, SbdvaNEBO3.
Rovněž je odolný vůči působení slabých kyselin; ale když je horký, je napaden kyselinou dusičnou a chlorovodíkovou.
Antimon má mnoho aplikací, mezi nimi se používá ve slitinách s olovem a cínem, při výrobě autobaterií, materiálů s nízkým třením atd..
Tento metaloid má vzácnou vlastnost zvyšování objemu, když tuhne, což umožňuje jeho slitinám plně zabírat prostor použitý k formování nástroje, který má být vyroben..
Rejstřík článků
- 1 Historie jeho objevu
- 1.1 Před Kristem
- 1.2 Zavedení pojmu
- 1.3 Získání
- 2 Struktura antimonu
- 2.1 Allotropie
- 3 Vlastnosti
- 3.1 Atomová hmotnost
- 3,2 atomové číslo
- 3.3 Elektronická konfigurace
- 3,4 oxidační stavy
- 3.5 Fyzický popis
- 3.6 Teplota tání
- 3.7 Bod varu
- 3.8 Hustota
- 3.9 Fúzní teplo
- 3.10 Odpařovací teplo
- 3.11 Molární tepelná kapacita
- 3.12 Elektronegativita
- 3.13 Atomový poloměr
- 3.14 Tvrdost
- 3.15 Stabilita
- 3.16 Izotopy
- 3.17 Elektrická a tepelná vodivost
- 3.18 Chemická reaktivita
- 4 použití
- 4.1 Slitiny
- 4.2 Zpomalovač hoření
- 4.3 Elektronické pole
- 4.4 Lékařské a veterinární
- 4.5 Pigmenty a barvy
- 4.6 Jiná použití
- 5 Rizika
- 6 Reference
Historie jeho objevu
před naším letopočtem
Existují důkazy, že od roku 3100 př. N.l. byl v Egyptě používán jako kosmetika sulfid antimonitý. V Mezopotámii, dnešním Iráku, byly nalezeny zbytky vázy a dalšího artefaktu, který pravděpodobně pochází z období 3000 až 2200 před naším letopočtem, ve kterém byl při jeho zpracování použit antimon..
Zavedení pojmu
Římský učenec Plinius starší (23–79 n. L.) Popsal ve svém Pojednání o přírodní historii použití antimonu, který nazval stibius, při přípravě sedmi léků. Alchymista Abu Mussa Jahir Ibn Hayyan (721-815) je připočítán se zavedením termínu antimon k pojmenování prvku.
Použil následující etymologii: „anti“ jako synonymum pro negaci a „mono“ pouze pro. Poté chtěl zdůraznit, že antimon se nenachází pouze v přírodě. Je již známo, že je součástí sulfidových minerálů a mnoha dalších prvků.
Získávání
Předpokládá se, že řecký naturista Pedanius Diascorides získal čistý antimon zahříváním sulfidu antimonitého v proudu vzduchu. Italský metalurg Vannocio Biringucio v knize De la Pirotecnia (1540) popisuje metodu izolace antimonu.
Německý chemik Andreas Libavius (1615) dosáhl použitím roztavené směsi železa, sulfidu antimonitého, soli a vínanu draselného výroby krystalického antimonu.
První podrobnou zprávu o antimonu vytvořil v roce 1707 francouzský chemik Nicolas Lemery (1645-1715) ve své knize Pojednání o antimonu.
Antimonová struktura
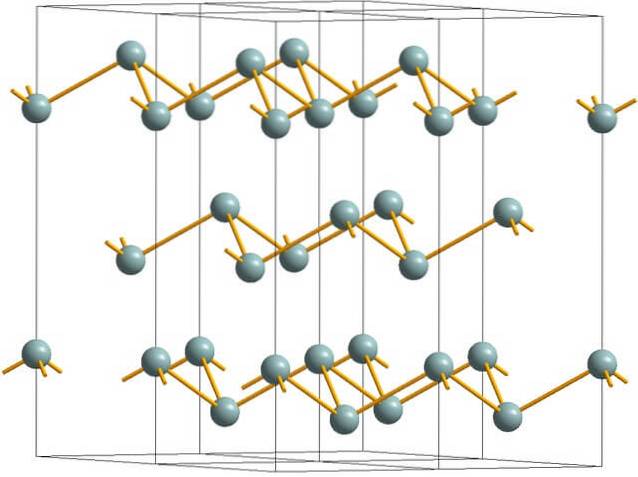
Horní obrázek ukazuje zvrásněnou vrstvenou strukturu přijatou atomy arsenu. Tuto strukturu však přebírá také šedý antimon, lépe známý jako kovový antimon. Říká se, že je „zvrásněná“, protože existují atomy Sb, které stoupají a padají z roviny složené z vrstvy.
Tyto vrstvy, i když jsou zodpovědné za fotony, které s nimi interagují, září stříbřitě, takže antimon přechází jako kov, pravdou je, že síly, které je spojují, jsou slabé; proto mohou být zjevné kovové fragmenty Sb snadno rozemleté a křehké nebo šupinaté.
Atomy Sb ve vrásčitých vrstvách také nejsou dostatečně blízko, aby seskupily své atomové orbitaly dohromady a vytvořily pás umožňující elektrické vedení..
Při individuálním pohledu na šedivou kouli je vidět, že má tři vazby Sb-Sb. Z vyšší roviny bylo vidět Sb ve středu trojúhelníku a tři Sb umístěné na jeho vrcholech. Trojúhelník však není plochý a má dvě úrovně nebo patra..
Boční reprodukce takových trojúhelníků a jejich vazeb vytváří vrásčité vrstvy, které se srovnávají a tvoří kosočtverečné krystaly..
Allotropy
Právě popsaná struktura odpovídá šedivému antimonu, nejstabilnějšímu z jeho čtyř alotropů. Další tři alotropy (černé, žluté a výbušné) jsou metastabilní; to znamená, že mohou existovat za velmi drsných podmínek.
O jejich strukturách není mnoho informací. Je však známo, že černý antimon je amorfní, takže jeho struktura je chaotická a složitá..
Žlutý antimon je stabilní pod -90 ° C, chová se jako nekovový prvek a lze předpokládat, že se skládá z malých aglomerátů typu Sb4 (podobné jako u fosforu); při zahřátí se transformuje na černý allotrope.
A pokud jde o výbušný antimon, sestává z želatinového povlaku vytvořeného na katodě během elektrolýzy vodného roztoku halogenidu antimonitého..
Při sebemenším silném tření nebo nárazu měkká pevná látka uvolňuje tolik tepla, že exploduje a stabilizuje se, když se její atomy přeskupí v kosodélníkové krystalické struktuře šedivého antimonu..
Vlastnosti
Atomová hmotnost
121,76 g / mol.
Protonové číslo
51.
Elektronická konfigurace
[Kr] 4d105 sdva5 str3.
Oxidační stavy
-3, -2, -1, +1, +2, +3, +4, +5.
Fyzický popis
Lesklé stříbrné pevné, křehké, se šupinatým povrchem, s namodralým odstínem. Může také vypadat jako černý prášek.
Bod tání
630,63 ° C.
Bod varu
1 635 ° C.
Hustota
-6 697 g / cm3 pokojová teplota.
-6,53 g / cm3 v kapalném stavu teplota stejná nebo vyšší než teplota tání.
Teplo fúze
19,79 kJ / mol.
Odpařovací teplo
193,43 kJ / mol.
Molární tepelná kapacita
25,23 J / mol.K
Elektronegativita
2,05 (Paulingova stupnice).
Atomové rádio
140 hodin.
Tvrdost
Jedná se o měkký prvek s tvrdostí 3 podle Mohsovy stupnice a může být poškrábán sklem.
Stabilita
Je stabilní při pokojové teplotě, bez oxidace. Je také odolný proti působení kyselin.
Izotopy
Má dva stabilní izotopy: 121Sb a 123Sb. Kromě toho existuje 35 radioaktivních izotopů. Radioaktivní izotop 125Sb je nejdelší poločas rozpadu: 2,75 roku. Radioaktivní izotopy obecně emitují β záření+ a β-.
Elektrická a tepelná vodivost
Antimon je špatný vodič tepla a elektřiny.
Chemická reaktivita
Nemůže vytěsnit vodík ze zředěných kyselin. Tvoří iontové komplexy s organickými a anorganickými kyselinami. Kovový antimon nereaguje se vzduchem, ale ve vlhkém vzduchu se rychle přeměňuje na oxid..
Halogeny a sulfidy snadno oxidují antimon, pokud k procesu dochází při zvýšených teplotách.
Aplikace
Slitiny
Antimon se používá ve slitině s olovem k výrobě desek pro autobaterie, což zvyšuje odolnost desek a vlastnosti nábojů..
Slitina s olovem a cínem byla použita ke zlepšení vlastností svarů, stejně jako u stopovacích střel a patronových rozbušek. Používá se také ve slitinách pro potahování elektrických kabelů..
Antimon se používá v antifrikčních slitinách, při výrobě cínové a kalicí slitiny s nízkým obsahem cínu při výrobě varhan a jiných hudebních nástrojů..
Má vlastnost, sdílenou s vodou, zvyšování objemu, když kondenzuje; Antimon přítomný ve slitinách s olovem a cínem proto vyplňuje všechny prostory ve formách a zlepšuje definici struktur vyrobených s uvedenými slitinami..
Zpomalovač ohně
Oxid antimonitý se používá k výrobě sloučenin zpomalujících hoření, vždy v kombinaci s halogenovanými samozhášeči, bromidy a chloridy..
Zpomalovače hoření mohou reagovat s atomy kyslíku a OH radikály, což inhibuje oheň. Tyto zpomalovače hoření se používají v dětském oblečení, hračkách, letadlech a v autosedačkách.
Přidávají se také do polyesterových pryskyřic a do kompozitů ze skleněných vláken pro předměty používané jako kryty motorů lehkých letadel..
Antimonové sloučeniny, které se používají jako retardéry hoření, zahrnují: oxychlorid antimonitý, SbOCl; oxid antimonitý, SbO5; chlorid antimonitý, SbCl3; a oxid antimonitý, SbO3.
Elektronické pole
Používá se při výrobě polovodičů, diod, detektorů střední infračervené oblasti a při výrobě tranzistorů. Antimon vysoké čistoty používaný v polovodičové technologii se získává redukcí sloučenin antimonu vodíkem.
Léčivé a veterinární
Antimonové sloučeniny se v medicíně používají od starověku jako emetika a antiprotozoa. Jako antischistosom byl po dlouhou dobu používán vínan draselno-draselný (zvracení zubního kamene); používá se navíc jako expektorans, pohoršující a zvracení.
Antimonové soli byly také použity při úpravě kůže přežvýkavců; jako je aniomalin a thiomalát lithný antimon.
Meglumin antimoniát je lék používaný při léčbě leishmaniózy u vnějších ložisek domácích zvířat. Terapeutické výhody však byly omezené.
Pigmenty a barvy
Antimonové sloučeniny se používají při výrobě nátěrových hmot a kalidla ve smaltech. Používají se také ve vermilionových, žlutých a oranžových pigmentech, které jsou produkty pomalé oxidace sulfidů antimonu..
Některé z jeho organických solí (tartráty) se používají v textilním průmyslu jako pomoc při vázání určitých barviv.
Sulfid antimonitý se ve starověkém Egyptě používal jako kosmetika k zatemnění očí.
Jiná použití
Některé antimonové soli se používají jako potahovací látky k odstranění mikroskopických bublin, které se tvoří na televizních obrazovkách. Antimonové ionty interagují s kyslíkem, čímž eliminují jeho tendenci vytvářet bubliny.
Sulfid antimonitý (III) se používá v hlavách některých bezpečnostních zápalek. Sulfid antimonitý se také používá ke stabilizaci koeficientu tření materiálů používaných v automobilových brzdových destičkách..
Izotop 124Sb se spolu s beryliem používá jako zdroj neutronů s energetickým průměrem 24 keV. Antimon se navíc používá jako katalyzátor při výrobě plastů..
Rizika
Je to křehký prvek, takže při jeho manipulaci může vznikat znečišťující prach z okolí. U pracovníků vystavených působení antimonového prachu byly pozorovány dermatitidy, renitidy, záněty horních cest dýchacích a zánět spojivek.
Po dlouhodobých expozicích byla popsána pneumokonióza, někdy kombinovaná s obstrukčními plicními změnami.
Oxid antimonitý může způsobit život ohrožující poškození funkce srdce.
U lidí vystavených tomuto prvku byla pozorována přítomnost přechodných pustulárních kožních infekcí..
Trvalý příjem nízkých dávek tohoto kovu může způsobit průjem, zvracení a žaludeční vředy. Stejně tak je maximální přípustná koncentrace ve vzduchu 0,5 mg / m3.
Reference
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Manny. (11. března 2009). Žlutý antimon a výbušný antimon. Obnoveno z: antimonyproperties.blogspot.com
- Ernst Cohen a J. C. Van Den Bosch. (1914). Allotropy Antimony. Sborník Royal Acad. Amsterdam. Sv. XVII.
- Wikipedia. (2019). Antimon. Obnoveno z: en.wikipedia.org
- Advameg, Inc. (2019). Antimon. Obnoveno z: chemistryexplained.com
- Sable Mc'Oneal. (15. září 2018). Chemie: vlastnosti a aplikace Sb-Antimony. Obnoveno z: medium.com



Zatím žádné komentáře