
Struktura bromthymolové modři, vlastnosti, příprava, použití
The bromtymolová modrá Je to barvivo citlivé na pH prostředí a bylo používáno jako indikátor v mnoha laboratorních reakcích. Indikátor je organické barvivo, jehož barva závisí na koncentraci H iontu.3NEBO+ nebo pH média. Podle barvy, kterou zobrazuje, může indikátor indikovat kyselost nebo zásaditost roztoku.
Bromthymolová modrá má aktivní indikační stupnici mezi pH 6,0 a 7,6. Při pH média nižším než 6,5 vykazuje žluté zbarvení. Když se pH média pohybuje mezi 6,5 a 7,6, získává zelenou barvu. Při pH vyšším než 7,6 je jeho barva modrá.

Díky této vlastnosti je tento indikátor velmi užitečný, protože může být použit v měřítku pH blízkém neutrality; přesně tam, kde dochází k fyziologickým procesům.
Ionizaci bromthymolové modři ve vodném roztoku lze popsat následovně:
HIn (žlutá barva) + HdvaNEBO <=> v- (modrá barva) + H3NEBO+
Když je indikátor protonovaný (HIn), získává žlutou barvu; zatímco pokud je deprotonovaný indikátor (In-) se změní na modrou.
Rejstřík článků
- 1 Chemická struktura
- 1.1 Změny pH
- 2 Vlastnosti
- 2.1 Chemický název
- 2.2 Molekulární vzorec
- 2.3 Molekulová hmotnost
- 2.4 Fyzický vzhled
- 2.5 Chemická charakteristika
- 2.6 Iontová disociační konstanta (Ka)
- 2.7 Aktivní rozsah indikace
- 2.8 Hustota
- 2.9 Teplota tání
- 2.10 Bod varu
- 2.11 Rozpustnost
- 2.12 Stabilita
- 2.13 Absorpce světla
- 3 Použití a aplikace
- 3.1 V metabolických studiích
- 3.2 V porodnictví
- 3.3 Jiná použití
- 4 Příprava
- 5 Reference
Chemická struktura
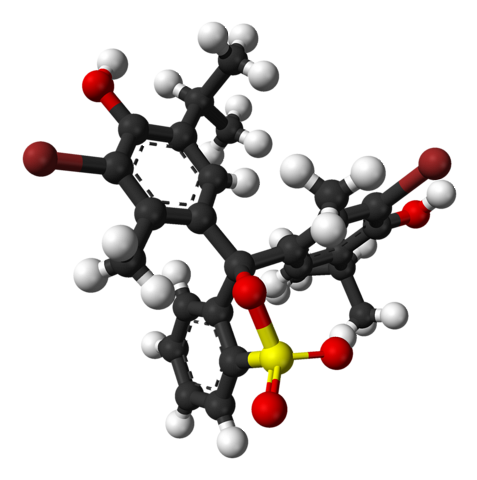
Horní obrázek představuje strukturu bromthymolové modři s modelem tyčinky a koule při pH nižším než 7,1. Hnědé sloupce odpovídají atomům bromu, celkem dvěma.
Každý ze tří aromatických kruhů tvoří společně s methylovými skupinami CH3, a terc-butyl, thymolová skupina; a po připojení Br, odtud vyvstává důvod, proč se mu říká „bromtymol“.
V dolní části je zobrazena sulfonátová skupina, R-SO3-, s červenými koulemi a žlutou. Tato skupina může být připojena prostřednictvím atomu O k centrálnímu uhlíku, který spojuje tři aromatické kruhy.
Změny pH
Ačkoli se tato molekulární struktura radikálně nemění s kyselým nebo zásaditým pH, její elektronické stavy se mění, což se odráží změnami barvy roztoků.
Pod hodnotou pH 7 má indikátor žlutou barvu a přijímá strukturu obrazu; ale pokud se pH stane zásaditým, mohou se vytvořit deprotonátové -OH skupiny a může se vytvořit dvojná vazba C = O.
Výsledkem je, že konjugovaný systém molekuly (systém všech jeho rezonančních dvojných vazeb) se mění natolik, že elektrony již neabsorbují stejné fotony a roztok se změní ze žluté na modravou..
Pokud je naopak hodnota pH výrazně pod 7, změní se barva indikátoru ze žluté na červenou. Zde je změna v konjugovaném systému způsobena protonací -OH skupin na -OHdva+. -
V kyselém i zásaditém prostředí ztrácí molekula stabilitu a absorbuje fotony s nižší energií, aby umožnila elektronické přechody odpovědné za barvy vnímané diváky..
A co zelená barva hlavního obrázku? Jak se pH blíží 7,1, malá část molekul ztrácí protony a vydává modrou barvu, která po smíchání se žlutou dává zelenou barvu..
Vlastnosti
Chemický název
Bromthymolová modř nebo 3,3'-dibromtymolsulfonaftalein.
Molekulární vzorec
C27H28BrdvaNEBO5S.
Molekulární váha
624,384 g / mol.
Fyzický vzhled
Pevný prášek s barvou od růžové po fialovou.
Chemická charakteristika
Působí jako slabá kyselina v roztoku. Když je protonován v kyselém prostředí, získává žlutou barvu, při neutrálním pH je zelený a když je deprotonován v alkalickém pH, je modrý.
Iontová disociační konstanta (Ka)
7,9 x 10-8.
Aktivní rozsah indikace
pH 6,0 až 7,6. To je způsobeno přítomností atomů bromu, které působí na extrakci elektronů, a dvěma mírnými donorovými skupinami elektronů (alkylové substituenty).
Hustota
1,25 g / cm3.
Bod tání
202 ° C (396 ° F).
Bod varu
184,9 ° C.
Rozpustnost
Je špatně rozpustný ve vodě a oleji. Rovněž je špatně rozpustný v nepolárních rozpouštědlech, jako je benzen, toluen a xylen, a prakticky nerozpustný v petroletheru. Je rozpustný ve vodných alkalických roztocích a v alkoholu.
Stabilita
Je stabilní při pokojové teplotě a nekompatibilní se silnými oxidačními činidly.
Absorpce světla
Protonovaná forma má maximální absorpci při vlnové délce (λ) 427 nm, čímž přenáší žluté světlo v kyselých roztocích, a deprotonovaná forma má maximální absorpci při vlnové délce (λ) 602 nm, přičemž propouští modré světlo při alkalickém pH..
Použití a aplikace
V metabolických studiích
Bromthymolová modrá se používá v mnoha procesech, při kterých se používá oxid uhličitý (COdva), s následnou tvorbou kyseliny uhličité (HdvaCO3), který okyseluje médium; o čemž svědčí změna zabarvení bromthymolové modři.
Pokud osoba vykonává fyzické cvičení a je připojena k trubici, která je zase připojena k nádobě s roztokem bromthymolové modři, bude pozorován následující jev: v důsledku zvýšené fyzické aktivity a metabolismu dojde k zvýšení produkce COdva.
COdva bude reagovat s vodou za vzniku kyseliny uhličité, HdvaCO3, který následně disociuje uvolněním H iontu+ a okyselení média. V důsledku toho získá bromthymolová modrá žlutou barvu, což zvýrazní kyselost média..
V porodnictví
Bromotymolová modrá se v porodnictví používá k prokázání časného prasknutí membrán. Plodová voda má normálně pH vyšší než 7,7, takže bromthymolová modř se při kontaktu s tekutinou prosakující z amnionu zbarví modře..
Vaginální pH je obvykle kyselé, takže bromtymolová modrá má žlutý odstín. Změna barvy na modrou zvýrazňuje přítomnost plodové vody ve vaginální oblasti.
Jiná použití
Bromotymolová modř má uplatnění také v následujících zařízeních a funkcích:
-Optické senzory
-Detekční systémy spalování plynů
-Při výrobě barev, hraček, čisticích prostředků, detergentů a textilu
-Senzory čerstvosti potravin
-Jako rukojeť pro čerstvou a zatuchlou rýži
-Při detekci mikroorganismů.
Používá se také při analýze bakteriálního růstu, psychoaktivních drog a dentálních materiálů..
Příprava
100 mg bromthymolové modři se rozpustí ve 100 ml zředěného alkoholu a v případě potřeby se zfiltruje. Připravuje se také následujícím způsobem: 50 mg bromthymolové modři se rozpustí ve směsi 4 ml 0,02 N hydroxidu sodného a 20 ml alkoholu a doplní se na 100 ml vodou..
Reference
- Wikipedia. (2018). Bromotymolová modrá. Obnoveno z: en.wikipedia.org
- Foist L. (2018). Bromotymolová modrá: definice, použití a vzorec. Studie. Obnoveno z: study.com
- Vědecká společnost. (2018). Bromotymolový modrý indikátor pH, 1 oz. Obnoveno z: sciencecompany.com
- Spektrofotometrické stanovení pK indikátoru bromthymolové modři. Obnoveno z: fch.upol.cz
- PubChem. (2018). Bromotymolová modrá. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Royal Society of Chemistry. (2015). Bromotymolová modrá. ChemSpider. Obnoveno z: chemspider.com
- Whitten, Davis, Peck a Stanley. (2008). Chemie. (8. vydání). Učení CENGAGE.



Zatím žádné komentáře