
Struktura, vlastnosti a použití bromidu stříbrného (AgBr)
The bromid stříbrný je to anorganická sůl, jejíž chemický vzorec je AgBr. Jeho pevná látka se skládá z kationtů Ag+ a Br anionty- v poměru 1: 1, přitahované elektrostatickými silami nebo iontovými vazbami. Je vidět, že kovové stříbro dalo jeden ze svých valenčních elektronů molekulárnímu bromu.
Svou povahou připomíná „sourozence“ chlorid stříbrný a jodid. Všechny tři soli jsou nerozpustné ve vodě, mají podobné barvy a jsou také citlivé na světlo; to znamená, že procházejí fotochemickými reakcemi. Tato vlastnost byla použita při získávání fotografií v důsledku redukce iontů Ag+ na kovové stříbro.
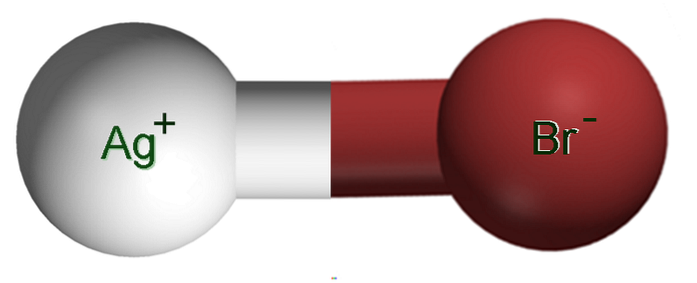
Obrázek výše ukazuje iontový pár Ag+Br-, ve kterém bílá a hnědá koule odpovídají iontům Ag+ a Br-, resp. Zde představují iontovou vazbu jako Ag-Br, ale je nutné naznačit, že neexistuje žádná taková kovalentní vazba mezi oběma ionty.
Může se zdát rozporuplné, že stříbro přispívá černou barvou k fotografiím bez barev. Je to proto, že AgBr reaguje se světlem a vytváří latentní obraz; což se pak zesiluje zvýšením redukce stříbra.
Rejstřík článků
- 1 Struktura bromidu stříbrného
- 1.1 Vady krystalů
- 2 Syntéza
- 3 Vlastnosti
- 3.1 Vzhled
- 3.2 Molekulová hmotnost
- 3.3 Hustota
- 3.4 Bod tání
- 3.5 Bod varu
- 3.6 Rozpustnost ve vodě
- 3.7 Index lomu
- 3.8 Tepelná kapacita
- 3.9 Citlivost na světlo
- 4 použití
- 5 Reference
Struktura bromidu stříbrného
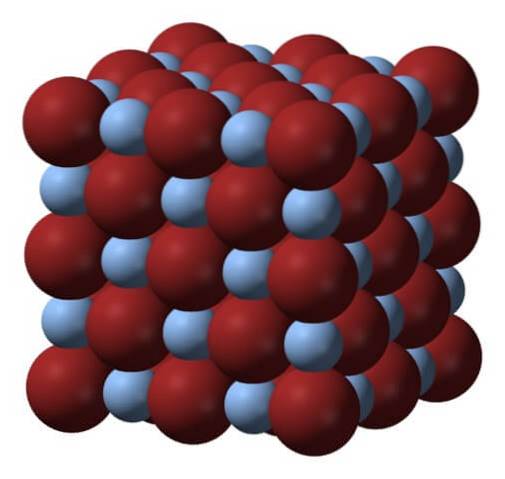
Nahoře je mřížka nebo krystalová struktura bromidu stříbrného. Zde je věrnější znázornění rozdílu ve velikosti mezi iontovými poloměry Ag+ a Br-. Br anionty-, objemnější opouštějí mezery, kde se nacházejí kationty Ag+, který je obklopen šesti Br- (a naopak).
Tato struktura je charakteristická pro krychlový krystalický systém, konkrétně typu kamenné soli; totéž, například jako pro chlorid sodný, NaCl. Ve skutečnosti to obraz usnadňuje uspořádáním dokonalé kubické hranice.
Na první pohled je vidět, že mezi ionty existuje určitý rozdíl ve velikosti. Toto a možná i elektronické vlastnosti Ag+ (a možný účinek některých nečistot) vede k tomu, že krystaly AgBr vykazují defekty; tj. místa, kde je „rozbitá“ pořadí iontů v prostoru.
Vady krystalů
Tyto defekty se skládají z dutin zanechaných chybějícími nebo přemístěnými ionty. Například mezi šesti Br anionty- normálně by měl být kation Ag+; ale místo toho může dojít k prázdnotě kvůli stříbře, které se dostalo do jiné mezery (Frenkelova vada).
I když ovlivňují krystalovou mřížku, upřednostňují reakce stříbra se světlem; a čím větší jsou krystaly nebo jejich shluk (velikost zrn), tím větší je počet defektů, a proto bude citlivější na světlo. Stejně tak nečistoty ovlivňují strukturu a tuto vlastnost, zejména ty, které lze redukovat elektrony..
V důsledku toho vyžadují velké krystaly AgBr menší vystavení světlu, aby je snížily; to znamená, že jsou více žádoucí pro fotografické účely.
Syntéza
V laboratoři lze bromid stříbrný syntetizovat smícháním vodného roztoku dusičnanu stříbrného AgNO3, se solí bromidu sodného, NaBr. První sůl přispívá stříbrem a druhá bromid. Následuje dvojité vytěsnění nebo reakce metateze, kterou lze vyjádřit chemickou rovnicí níže:
AgNO3(aq) + NaBr (s) => NaNO3(aq) + AgBr (s)
Všimněte si, že dusičnan sodný, NaNO3, je rozpustný ve vodě, zatímco AgBr se vysráží ve formě pevné látky se slabě žlutou barvou. Potom se pevná látka promyje a podrobí vakuovému sušení. Kromě NaBr by KBr mohl být také použit jako zdroj bromidových aniontů.
Na druhou stranu AgBr lze přirozeně získat pomocí minerálního bromitanu a jeho náležitých procesů čištění..
Vlastnosti
Vzhled
Jílovitá, bělavě žlutá pevná látka.
Molekulová hmotnost
187,77 g / mol.
Hustota
6,473 g / ml.
Bod tání
432 ° C.
Bod varu
1502 ° C.
Rozpustnost ve vodě
0,140 g / ml při 20 ° C.
Index lomu
2,253.
Tepelná kapacita
270 J / kg K.
Citlivost na světlo
V předchozí části bylo řečeno, že v krystalech AgBr existují defekty, které podporují citlivost této soli na světlo, protože zachycují vytvořené elektrony; a tím je teoreticky zabráněno jejich reakci s jinými druhy v prostředí, jako je kyslík ve vzduchu.
Elektron je uvolňován z Br reakce- s fotonem:
Br- + hv => 1 / 2Brdva + a-
Všimněte si, že se vyrábí Brdva, který odstraní červenou barvu, pokud není odstraněna. Uvolněné elektrony snižují kationty Ag+, v jeho mezerách, na kovové stříbro (někdy představované jako Ag0):
Ag+ + a- => Ag
Poté máme čistou rovnici:
AgBr => Ag + 1 / 2Brdva
Když se na povrchu vytvoří „první vrstvy“ kovového stříbra, říká se, že existuje latentní obraz, který je pro lidské oko stále neviditelný. Tento obraz se stane milionkrát viditelnějším, pokud jiné chemické látky (jako je hydrochinon a fenidon, v procesu vývoje) zvýší redukci krystalů AgBr na kovové stříbro.
Aplikace

Bromid stříbrný je nejpoužívanější ze všech svých halogenidů v oblasti vývoje fotografických filmů. AgBr se aplikuje na uvedené filmy, vyrobené z acetátu celulózy, suspendované v želatině (fotografická emulze) a v přítomnosti 4- (methylamino) fenol sulfátu (Metol) nebo fenidonu a hydrochinonu.
U všech těchto reagencií lze latentní obraz přivést k životu; dokončit a urychlit transformaci iontového na kovové stříbro. Pokud však nebudete postupovat s určitou péčí a zkušenostmi, všechno stříbro na povrchu oxiduje a kontrast mezi černou a bílou barvou skončí..
Proto jsou kroky zastavení, fixace a promočení fotografických filmů zásadní..
Existují umělci, kteří si s těmito procesy hrají tak, že vytvářejí odstíny šedé, které obohacují krásu obrazu a jejich vlastní odkaz; a to všechno dělají, někdy možná bez podezření, díky chemickým reakcím, jejichž teoretický základ se může stát trochu složitým, a díky světlocitlivému AgBr, který je výchozím bodem.
Reference
- Wikipedia. (2019). Bromid stříbrný. Obnoveno z: en.wikipedia.org
- Michael W. Davidson. (2015, 13. listopadu). Digitální galerie obrázků polarizovaného světla: Bromid stříbrný. Olympus. Obnoveno z: micro.magnet.fsu.edu
- Crystran Ltd. (2012). Bromid stříbrný (AgBr). Obnoveno z: crystran.co.uk
- Lothar Duenkel, Juergen Eichler, Gerhard Ackermann a Claudia Schneeweiss. (29. června 2004). Samostatně vyrobené emulze na bázi bromidu stříbrného pro uživatele v holografii: výroba, zpracování a aplikace, Proc. SPIE 5290, Praktická holografie XVIII: Materiály a aplikace; doi: 10,1117 / 12,525035; https://doi.org/10.1117/12.525035
- Alan G. Tvar. (1993). Anorganická chemie. (Druhé vydání.). Redakční reverté.
- Carlos Güido a Ma Eugenia Bautista. (2018). Úvod do fotografické chemie. Obnoveno z: fotografia.ceduc.com.mx
- García D. Bello. (9. ledna 2014). Chemie, fotografie a Chema Madoz. Obnoveno z: dimethylsulfuro.es



Zatím žádné komentáře