
Tepelně absorbované vzorce, jak to vypočítat a vyřešená cvičení
The absorbované teplo Je definován jako přenos energie mezi dvěma tělesy při různých teplotách. Ten s nižší teplotou absorbuje teplo toho s vyšší teplotou. Když k tomu dojde, tepelná energie látky, která absorbuje teplo, se zvyšuje a částice, které ji tvoří, vibrují rychleji a zvyšují tak svou kinetickou energii..
To může mít za následek zvýšení teploty nebo změnu stavu. Například přecházejte z pevné látky do kapaliny, jako je led, když se roztaví při kontaktu s vodou nebo sodou při pokojové teplotě.

Díky teplu je také možné, aby objekty změnily své rozměry. Dobrým příkladem tohoto jevu je tepelná roztažnost. Při zahřívání většiny látek obvykle dochází ke zvětšení jejich rozměrů.
Výjimkou je voda. Stejné množství kapalné vody zvětší svůj objem, když se ochladí pod 4 ° C. Kromě toho mohou změny teploty zaznamenat také změny v hustotě, což je v případě vody také velmi pozorovatelné..
Rejstřík článků
- 1 Z čeho se skládá a vzorce
- 1.1 Kalorie
- 2 Jak to vypočítat?
- 2.1 Energetická bilance
- 3 Cvičení vyřešeno
- 3.1 Přístup
- 3.2 Údaje
- 4 Odkazy
Z čeho se skládá a vzorce
V případě přepravované energie jsou jednotkami absorbovaného tepla Jouly. Po dlouhou dobu však teplo mělo své vlastní jednotky: kalorie.
I dnes se tato jednotka používá ke kvantifikaci energetického obsahu potravin, i když ve skutečnosti dietní kalorie odpovídá kilokaloriím tepla.
Kalorie
Kalorie, zkráceně jako Limetka, je množství tepla potřebné ke zvýšení teploty 1 gramu vody o 1 ° C.
V 19. století provedl Sir James Prescott Joule (1818 - 1889) slavný experiment, při kterém dokázal přeměnit mechanickou práci na teplo a získal následující ekvivalenci:
1 kalorie = 4,186 joulů
V britských jednotkách se jednotka tepla nazývá Btu (Britská tepelná jednotka), což je definováno jako množství tepla potřebné ke zvýšení teploty libry vody o 1 ° F.
Ekvivalence mezi jednotkami je následující:
1 Btu = 252 kalorií
Problém těchto starších jednotek spočívá v tom, že množství tepla závisí na teplotě. To znamená, že teplota požadovaná od 70 ° C do 75 ° C není stejná jako teplota potřebná například pro ohřev vody z 9 ° C na 10 ° C..
Proto definice předpokládá dobře definované rozmezí: od 14,5 do 15,5 ° C a 63 až 64 ° F pro kalorie a Btu..
Na čem závisí množství absorbovaného tepla?
Množství absorbovaného tepla, které materiál zachytí, závisí na několika faktorech:
- Hmotnost. Čím větší je hmotnost, tím více tepla je schopna absorbovat.
- Vlastnosti látky. Existují látky, které jsou v závislosti na své molekulární nebo atomové struktuře schopné absorbovat více tepla než jiné..
- Teplota. K dosažení vyšší teploty je nutné přidat více tepla.
Množství tepla, označené jako Q, je úměrná popsaným faktorům. Proto jej lze zapsat jako:
Q = m.c.T
Kde m je hmotnost objektu, C je neustálé volání měrné teplo, vnitřní vlastnost látky a ΔT je teplotní variace dosažená absorpcí tepla.
ΔT = TF - Tnebo
Tento rozdíl má kladné znamení, protože při absorpci tepla se to očekává TF > Tnebo. K tomu dochází, pokud látka neprochází fázovou změnou, například vodou přecházející z kapaliny do páry. Když voda vaří, její teplota zůstává konstantní na přibližně 100 ° C, bez ohledu na to, jak rychle se vaří..
Jak to vypočítat?
Uvedením dvou předmětů do kontaktu při různých teplotách dosáhnou oba po určité době tepelné rovnováhy. Poté se teploty vyrovnají a přestane přestup tepla. Totéž se stane, když přijdou do styku více než dva objekty. Po určité době budou mít všechny stejnou teplotu.
Za předpokladu, že předměty v kontaktu tvoří uzavřený systém, ze kterého nemůže unikat teplo, platí princip zachování energie, takže lze konstatovat, že:
Q vstřebává = - Q ustoupil
To představuje energetickou bilanci, obdobnou jako u příjmů a výdajů dané osoby. Z tohoto důvodu má přenášené teplo záporné znaménko, protože u objektu, který se získá, je konečná teplota nižší než počáteční. Proto:
ΔT = TF - Tnebo < 0
Q rovnice vstřebává = - Q ustoupil používá se vždy, když jsou dva objekty v kontaktu.
Energetická bilance
K provedení energetické bilance je nutné rozlišit objekty, které absorbují teplo od těch, které podstupují, a poté:
Σ Qk= 0
To znamená, že součet energetických zisků a ztrát v uzavřeném systému se musí rovnat 0.
Specifické teplo látky
Pro výpočet množství absorbovaného tepla je nutné znát specifické teplo každé zúčastněné látky. Jedná se o množství tepla potřebné ke zvýšení teploty 1 g materiálu o 1 ° C. Jeho jednotky v mezinárodním systému jsou: Joule / kg. K..
K dispozici jsou tabulky se specifickým teplem mnoha látek, které se obvykle počítají pomocí kalorimetru nebo podobných nástrojů..
Příklad toho, jak vypočítat měrné teplo materiálu
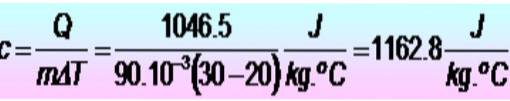
Ke zvýšení teploty kovového prstence z 20 na 30 ° C je zapotřebí 250 kalorií. Pokud má prsten hmotnost 90 g. Jaké je měrné teplo kovu v jednotkách SI??
Řešení
Nejprve jsou převedeny jednotky:
Q = 250 kalorií = 1046,5 J.
m = 90 g = 90 x 10-3 kg
Cvičení vyřešeno
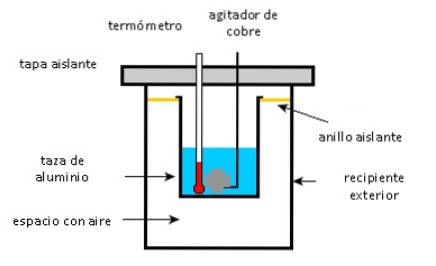
Hliníkový kelímek obsahuje 225 g vody a 40 g měděného míchadla, vše při 27 ° C. 400 g vzorku stříbra při počáteční teplotě 87 ° C se vloží do vody.
Míchadlo se používá k míchání směsi, dokud nedosáhne konečné rovnovážné teploty 32 ° C. Vypočítejte hmotnost hliníkového kelímku, vzhledem k tomu, že nedochází k tepelným ztrátám prostředí.
Přístup
Jak je uvedeno výše, je důležité rozlišovat mezi objekty, které se vzdávají tepla, od těch, které absorbují:
- Hliníkový kelímek, měděné míchadlo a voda absorbují teplo.
- Stříbrný vzorek poskytuje teplo.
Data
Specifické teplo pro každou látku je dodáváno:
- Stříbro: c = 234 J / kg. ºC
- Měď: c = 387 J / kg. ºC
- Hliník c = 900 J / kg. ºC
- Voda c = 4186 J / kg. ºC
Teplo absorbované nebo přenesené každou látkou se vypočítá pomocí rovnice:
Q = m.c.λT
Řešení
stříbrný
Q ustoupil = 400 x 10 -3 . 234 x (32 - 87) J = -5148 J
Měděné míchadlo
Q vstřebává = 40 x 10 -3 . 387 x (32 - 27) J = 77,4 J
Voda
Q vstřebává = 225 x 10 -3 . 4186 x (32 - 27) J = 4709,25 J
Hliníkový hrnek
Q vstřebává = m hliník . 900 x (32 - 27) J = 4500 m hliník
Využívá:
Σ Qk= 0
77,4 + 4709,25 + 4500 mil hliník = - (-5148)
Nakonec je hmotnost hliníku odstraněna:
m hliník = 0,0803 kg = 80,3 g
Reference
- Giancoli, D. 2006. Fyzika: Principy s aplikacemi. 6th. Ed. Prentice Hall. 400 - 410.
- Kirkpatrick, L. 2007. Fyzika: Pohled na svět. 6ta Zkrácené vydání. Cengage Learning. 156 - 164.
- Rex, A. 2011. Základy fyziky. Pearson. 309 - 332.
- Sears, Zemansky. 2016. Univerzitní fyzika s moderní fyzikou. 14th. Hlasitost 1. 556 - 553.
- Serway, R., Vulle, C. 2011. Základy fyziky. 9na Cengage Learning. 362 - 374



Zatím žádné komentáře