
Zahřejte zadané vzorce, jak je vypočítat a vyřešená cvičení
The vedlo teplo je přenos energie mezi dvěma tělesy při různých teplotách. Ten s vyšší teplotou odevzdává teplo tomu s nižší teplotou. Ať se tělo vzdá nebo absorbuje teplo, jeho teplota nebo fyzický stav se může lišit v závislosti na hmotnosti a vlastnostech materiálu, ze kterého je vyrobeno..
Dobrým příkladem je kouřící šálek kávy. Kovová lžíce, se kterou se cukr míchá, se zahřívá. Pokud zůstane v šálku dostatečně dlouho, káva a kovová lžíce nakonec vyrovnají jejich teploty: káva se ochladí a lžíce zahřeje. Jelikož systém není izolován, bude do okolního prostředí pronikat určité množství tepla.

Když se teploty vyrovnaly, tepelná rovnováha.
Pokud byste provedli stejný test s plastovou lžičkou, určitě byste si všimli, že se nezahřívá tak rychle jako kovová, ale nakonec se také vyrovná s kávou a vším kolem..
Je to proto, že kov vede teplo lépe než plast. Na druhou stranu káva jistě přináší teplo jinou rychlostí než horká čokoláda nebo jiný nápoj. Teplo dané nebo absorbované každým objektem tedy závisí na tom, z jakého materiálu nebo látky je vyroben..
Rejstřík článků
- 1 Z čeho se skládá a vzorce
- 1.1 Teplotní rozdíl ΔT
- 1.2 Specifické teplo a tepelná kapacita látky
- 2 Jak to vypočítat?
- 2.1 Kalorimetrie
- 3 Vyřešená cvičení
- 3.1 Cvičení 1
- 3.2 Cvičení 2
- 4 Odkazy
Z čeho se skládá a vzorce
Teplo se vždy vztahuje k toku nebo přenosu energie mezi jedním objektem a druhým v důsledku rozdílu teplot.
Proto mluvíme o přeneseném nebo absorbovaném teple, protože přidáním nebo extrahováním tepla nebo energie nějakým způsobem je možné upravit teplotu prvku.
Množství tepla, které vydává nejteplejší předmět, se obvykle nazývá Q. Tato hodnota je úměrná hmotnosti uvedeného objektu. Tělo s velkou hmotou je schopné vydávat více tepla než jiné těleso s nižší hmotností..
Teplotní rozdíl ΔT
Dalším důležitým faktorem při výpočtu uvolněného tepla je rozdíl teplot, který zažívá objekt, který uvolňuje teplo. Označuje se jako ΔT a počítá se takto:
ΔT = TF - Tnebo
Nakonec množství přeneseného tepla závisí také na povaze a vlastnostech objektu, které jsou kvantitativně shrnuty do konstanty zvané specifické teplo materiálu, označeno jako C.
Takže konečně výraz pro přenesené teplo je následující:
Qustoupil = - m.c.T
Vzdání se symbolizuje záporné znaménko.
Specifické teplo a tepelná kapacita látky
Specifické teplo je množství tepla potřebné ke zvýšení teploty 1 g látky o 1 ° C. Jedná se o vnitřní vlastnost materiálu. Jeho jednotky v mezinárodním systému jsou: Joule / kg. K (Joule mezi kilogramem x teplotou ve stupních Kelvina).
Tepelná kapacita C je propojený koncept, ale mírně odlišný, protože se jedná o hmotnost objektu. Tepelná kapacita je definována takto:
C = mc
Jeho jednotky v S.I. jsou to Joule / K. Uvolněné teplo lze tedy vyjádřit ekvivalentně jako:
Q = -C. ΔT
Jak to vypočítat?
Pro výpočet tepla vydávaného objektem je nutné znát následující:
- Specifické teplo látky, která se tepla vzdává.
- Hmotnost uvedené látky
- Získat konečnou teplotu
Specifické hodnoty tepla pro mnoho materiálů byly stanoveny experimentálně a jsou k dispozici v tabulkách.
Kalorimetrie
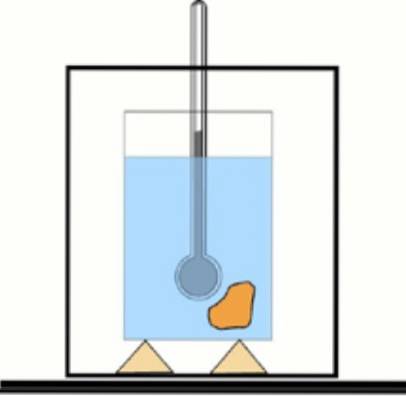
Pokud nyní není tato hodnota známa, je možné ji získat pomocí teploměru a vody v tepelně izolované nádobě: kalorimetru. Schéma tohoto zařízení je znázorněno na obrázku, který je doprovázen cvičením 1.
Vzorek látky se při určité teplotě ponoří do předem změřeného množství vody. Změří se konečná teplota a se získanými hodnotami se stanoví specifické teplo materiálu..
Porovnáním výsledku s tabulkovými hodnotami lze zjistit, o jakou látku jde. Tento postup se nazývá kalorimetrie.
Tepelná bilance se provádí šetřením energie:
Q ustoupil + Q absorbováno = 0
Vyřešená cvičení
Cvičení 1
Kus mědi o hmotnosti 0,35 kg se zavede při teplotě 150 ° C do 500 ml vody o teplotě 25 ° C.
a) Konečná rovnovážná teplota
b) Kolik tepla v tomto procesu proudí?
Data
Cměď = 385 J / kg. ºC
Cvoda = 4180 J / kg. ºC
Hustota vody: 1000 kg / m3
Řešení
a) Měď se vzdává tepla, zatímco voda jej absorbuje. Protože je systém považován za uzavřený, do tepelné bilance zasahují pouze voda a vzorek:
Q ustoupil = Q vstřebává
Na druhou stranu je nutné vypočítat hmotnost 500 ml vody:
500 ml = 0,5 l = 0,0005 m3
S těmito údaji se vypočítá hmotnost vody:
hmotnost = hustota x objem = 1000 kg / m3 . 0,0005 m3 = 0,5 kg
Rovnice pro teplo v každé látce se zvýší:
Qustoupil = -mměď . Cměď. ΔT = -0,35 kg. 385 J / kg. ° C . (T.F -150 ° C) = -134,75 (T.F - 150) J
Qvstřebává = mVoda . CVoda. ΔT = 0,5 kg. 4186 J / kg. ºC. (T.F -25 ° C) = 2093 (T.F -25) J
Porovnáme-li výsledky, máme:
2093 (T.F - 25) = -134,75 (T.F - 150)
Jedná se o lineární rovnici s jednou neznámou, jejíž řešení je:
TF = 32,56 ° C
b) Množství tepla, které proudí, je přenášené teplo nebo absorbované teplo:
Q ustoupil = - 134,75 (32,56 - 150) J = 15823 J.
Q vstřebává = 2093 (32,56 - 25) J = 15823 J
Cvičení 2
100 g mědi se zahřívá v peci na teplotu Tnebo a poté se zavede do měděného kalorimetru o hmotnosti 150 g obsahujícího 200 g vody při teplotě 16 ° C. Konečná teplota, která je jednou v rovnováze, je 38 ° C. Když se zváží kalorimetr a jeho obsah, zjistí se, že se odpařilo 1,2 g vody Co bylo počáteční teplota Tnebo?
Údaje: latentní teplo odpařování vody je Lproti = 2257 kJ / kg
Řešení
Toto cvičení se liší od předchozího, protože je třeba vzít v úvahu, že kalorimetr také absorbuje teplo. Teplo uvolněné kouskem mědi se investuje do všech následujících věcí:
- Zahřejte vodu v kalorimetru (200 g)
- Zahřejte měď, ze které je kalorimetr vyroben (150 g)
- Odpařte 1,2 gramu vody (energie je potřebná také pro fázovou změnu).
Qustoupil = -100 X 1 x 10 -3 kg. 385 J / kg. ºC. (38 - T.nebo ) ºC = -38.5. (38 - T.nebo) J.
Q absorbováno kalorimetr = Q absorbován vodou + Q vypařování + Q absorbován mědí
0,2 kg. 4186 J / kg ° C. (38 - 16 ° C) + 1,2 x 10-3 kg. 2257000 J / kg +0,150 kg 0,385 J / kg .ºC. (38-16 ° C) =
18418,4 + 2708,4 + 1270,5 J = 22397,3 J
Proto:
-38.5. (38 - T.nebo) = 22397,3
Tnebo = 619,7 ° C
Mohlo se také uvažovat o teple potřebném k tomu, aby se 1,2 g vody dostalo na 100 ° C, ale ve srovnání je to docela malé množství..
Reference
- Giancoli, D. 2006. Fyzika: Principy s aplikacemi. 6th. Ed. Prentice Hall. 400 - 410.
- Kirkpatrick, L. 2007. Fyzika: Pohled na svět. 6ta Zkrácené vydání. Cengage Learning. 156 - 164.
- Rex, A. 2011. Základy fyziky. Pearson. 309 - 332.
- Sears, Zemansky. 2016. Univerzitní fyzika s moderní fyzikou. 14th. Vydání Volume 1. 556 - 553.
- Serway, R., Vulle, C. 2011. Základy fyziky. 9na Cengage Learning.



Zatím žádné komentáře