
Struktura uhličitanu draselného (K2CO3), vlastnosti, použití, výroba

The Uhličitan draselný je anorganická sloučenina tvořená dvěma ionty draslíku K.+ a uhličitanový ion CO3dva-. Jeho chemický vzorec je K.dvaCO3. Je to hygroskopická bílá pevná látka, to znamená, že snadno absorbuje vodu z prostředí. Z tohoto důvodu se v laboratořích používá k absorpci vody z jiných látek..
Je velmi rozpustný ve vodě a vytváří zásadité roztoky, které jsou bohaté na OH ionty.-a proto s vysokou hodnotou pH. Jeho vodné roztoky, které jsou zásadité, se používají v různých průmyslových procesech k absorpci kyselých plynů, jako je oxid uhličitý COdva a sirovodík HdvaAno, snadno je neutralizuje.

KdvaCO3 Používá se k přípravě mýdel, čisticích prostředků, pracích prostředků a směsí na mytí nádobí. Používá se také při zpracování některých textilních vláken, jako je vlna..
Je široce používán v chemických laboratořích, například k absorpci vody z jiných sloučenin nebo k alkalizaci směsí chemických reakcí a také při chemické analýze.
Přidává se také do některých potravin, například k eliminaci hořké chuti kakaových bobů během výroby čokolády..
Rejstřík článků
- 1 Struktura
- 2 Názvosloví
- 3 Vlastnosti
- 3.1 Fyzický stav
- 3,2 Molekulová hmotnost
- 3.3 Teplota tání
- 3.4 Bod varu
- 3.5 Hustota
- 3.6 Rozpustnost
- 3,7 pH
- 3.8 Chemické vlastnosti
- 4 Získání
- 5 použití
- 5.1 Při absorpci CO2 v průmyslových procesech
- 5.2 Při odstraňování H2S z určitých procesů
- 5.3 V chemických laboratořích
- 5.4 V průmyslu čisticích prostředků
- 5.5 V potravinářském průmyslu
- 5.6 V hnojivech
- 5.7 V různých aplikacích
- 6 Reference
Struktura
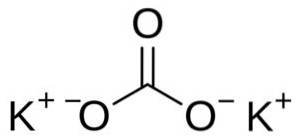
Uhličitan draselný se skládá ze dvou kationtů draslíku K.+ a uhličitanový anion CO3dva-. Uhličitanový anion má plochou a symetrickou strukturu, zatímco tři atomy kyslíku obklopují uhlík a tvoří plochý trojúhelník..
Nomenklatura
- Uhličitan draselný
- Uhličitan draselný
- Uhličitan disodný
- Potaš
- Draselná sůl kyseliny uhličité.
Vlastnosti
Fyzický stav
Bezbarvá až bílá krystalická pevná látka.
Molekulární váha
138,205 g / mol.
Bod tání
899 ° C.
Bod varu
Rozkládá se.
Hustota
2,29 g / cm3
Rozpustnost
Velmi dobře rozpustný ve vodě: 111 g / 100 g vody při 25 ° C. Nerozpustný v ethanolu a acetonu.
pH
Vodný roztok může mít pH 11,6, to znamená, že je zcela zásaditý.
Chemické vlastnosti
Uhličitan draselný je rozplývavý nebo hygroskopický, to znamená, že absorbuje vlhkost z prostředí. Má stabilní hydrát, K.dvaCO3.2HdvaNEBO.
KdvaCO3 ve vodném roztoku hydrolyzuje, to znamená, že reaguje s vodou a uvolňuje OH skupiny- které dávají roztokům zásaditost:
CO3dva- + HdvaO ⇔ OH- + HCO3-
HCO3- + HdvaO ⇔ OH- + HdvaCO3
Získávání
Lze jej získat z popela, který zůstává při spalování rostlin. Také karbonatací hydroxidu draselného KOH, to znamená přidáním přebytečného oxidu uhličitého COdva na KOH:
KOH + COdva → KHCO3
2 KHCO3 + teplo → K.dvaCO3 + HdvaNEBO
Dalším způsobem, jak jej získat, je zahřátí chloridu draselného KCl na uhličitan hořečnatý MgCO3, voda a COdva pod tlakem. Nejprve se získá hydratovaná podvojná sůl hořčíku a draslíku3.KHCO3.4HdvaNebo nazývaná Engelsova sůl:
2 KCl + 3 MgCO3 + COdva + 5 hdvaO → MgCO3.KHCO3.4HdvaO ↓ + MgCldva
Engelsova hydratovaná podvojná sůl se vysráží a odfiltruje se z roztoku. Poté se zahřeje a vytvoří se uhličitan draselný K.dvaCO3 že při přidávání vody se rozpouští, zatímco uhličitan hořečnatý MgCO3 zůstává nerozpustný a odstraní se filtrací.
MgCO3.KHCO3.4HdvaO + teplo → MgCO3↓ + 2 tis+ + CO3dva- + COdva↑ + 9 hodindvaNEBO
Aplikace
Při absorpci COdva v průmyslových procesech
Roztok uhličitanu draselného je klasickým způsobem odstraňování oxidu uhličitého COdva v různých procesech, zejména ve vysokotlakých a vysokoteplotních aplikacích.

Odstranění COdva dochází podle následující reakce:
K.dvaCO3 + COdva + HdvaO ⇔ 2 KHCO3
Tato metoda se používá například k úpravě zemního plynu. Také v elektrárnách, aby se zabránilo emisím COdva do atmosféry a při výrobě suchého ledu.

Řešení K.dvaCO3 lze tepelně regenerovat, to znamená zahřátím na teplotu kolem 100 ° C.
Aby roztok uhličitanu draselného mohl absorbovat CO2 dobrou rychlostí, přidávají se promotory, které urychlují proces, jako je diethanolamin (DEA)..
Při odstraňování HdvaS určitých procesů
K odstranění plynného sirovodíku H se také používají roztoky uhličitanu draselnéhodvaS pro procesní toky. Někdy se přidává trifosforečnan draselný3PO4 pro urychlení procesu.
V chemických laboratořích
KdvaCO3 Umožňuje provádět organické syntézy, například při kondenzačních reakcích a neutralizovat. Používá se k odstranění vody z organických kapalin, jako dehydratační činidlo nebo vysoušedlo v laboratoři.
Používá se také při reakcích analytické chemie a pro alkalizaci ve farmaceutickém průmyslu..
V průmyslu čisticích prostředků
KdvaCO3 Používá se k výrobě mýdla, čisticích přípravků, výrobků na praní a mytí nádobí a také k přípravě šamponů a jiných výrobků osobní hygieny.

V potravinářském průmyslu
Uhličitan draselný se přidává do různých potravin pro různé účely.
Například se přidává do kakaových bobů, aby odstranila jejich hořkou chuť a použila je při výrobě čokolády. Přidává se do hroznů v procesu sušení, aby se získaly rozinky.

V těstě se používá jako kypřící prostředek (který působí jako droždí) pro mouku k přípravě pečiva..

V hnojivech
KdvaCO3 Používá se k hnojení kyselých půd, protože uhličitanový ion CO3dva- při kontaktu s vodou produkuje ionty OH- které zvyšují pH půdy. Plus draslík K.+ je to živina pro rostliny.
Uhličitan draselný se také používá k výrobě hnojiv s pomalým uvolňováním.
Pomalu se uvolňující hnojivo uvolňuje nebo uvolňuje živiny pomalu, aby nebyly rozpuštěny a odplaveny. Díky tomu budou moci trávit více času dostupného kořenům rostliny.
V různých aplikacích
Uhličitan draselný K.dvaCO3 také se používá k:
- Barvení, bělení a čištění surové vlny a další činnosti textilního průmyslu
- Získání dalších organických a anorganických draselných solí, jako je KCN kyanid draselný.
- Funguje jako regulátor kyselosti v různých procesech.
- Výroba keramiky a keramiky.
- Rytí a litografické procesy.
- Činění a konečná úprava kůže.
- Připravte inkousty pro tisk, pigmenty.
- Výroba brýlí zejména pro televizi, protože K.dvaCO3 je více kompatibilní než uhličitan sodný NadvaCO3 s oxidy olova, barya a stroncia obsaženými v těchto brýlích.
- Úprava vody.
- Zpomalovač hoření (ve formě vodných roztoků).
- Inhibujte korozi a jako prostředek proti znečištění v procesním zařízení.
Reference
- NÁS. Národní lékařská knihovna. (2019). Uhličitan draselný. Obnoveno z pubchem.ncbi.nlm.nih.gov.
- Steele, D. (1966). Chemie kovových prvků. Pergamon Press Ltd. Londýn.
- Mokhatab, S. a kol. (2019). Zpracování zemního plynu. Roztok uhličitanu draselného. V příručce pro přepravu a zpracování zemního plynu (čtvrté vydání). Obnoveno ze sciencedirect.com.
- Kakaras, E. a kol. (2012). Systémy kombinovaného cyklu tlakového fluidního spalování (PFBC). Spalování ve fluidním loži pod tlakem se zachytáváním a ukládáním uhlíku. V systémech s kombinovaným cyklem pro výrobu energie s téměř nulovými emisemi. Obnoveno ze sciencedirect.com.
- Speight, J.G. (2019). Výroba vodíku. Mokré drhnutí. V těžbě a modernizaci těžkého oleje. Obnoveno ze sciencedirect.com.
- Branan, C.R. (2005). Plynové zpracování: Kapitola aktualizována Chrisem Higmanem. Horké uhličitanové procesy. V pravidlech pro chemické inženýry (čtvrté vydání). Obnoveno ze sciencedirect.com.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Čtvrté vydání. John Wiley & Sons.
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). Páté vydání. VCH Verlagsgesellschaft mbH.
- Li, Y. a Cheng, F. (2016). Syntéza nového draselného hnojiva s pomalým uvolňováním z modifikované hořčíkové strusky Pidgeon uhličitanem draselným. J Air Waste Manag Assoc, 2016 srpen; 66 (8): 758-67. Obnoveno z ncbi.nlm.nih.gov.



Zatím žádné komentáře