
Uhlík v přírodě umístění, vlastnosti a použití

The uhlík v přírodě Mezi mnoha dalšími nastaveními se nachází v diamantech, olejích a grafitech. Tento chemický prvek zaujímá šesté místo v periodické tabulce a je umístěn ve vodorovné řadě nebo období 2 a sloupci 14. Je nekovový a čtyřmocný; to znamená, že můžete vytvořit 4 sdílené elektronově chemické vazby nebo kovalentní vazby.
Uhlík je nejhojnějším prvkem v zemské kůře. Toto množství, jeho jedinečná rozmanitost při tvorbě organických sloučenin a jeho výjimečná schopnost tvořit makromolekuly nebo polymery při teplotách běžně se vyskytujících na Zemi, z něj činí společný prvek všech známých forem života..

Uhlík v přírodě existuje jako chemický prvek, aniž by se kombinoval ve formě grafitu a diamantu. Většinou se však kombinuje za vzniku uhlíkových chemických sloučenin, jako je uhličitan vápenatý (CaCO3) a další sloučeniny v ropě a zemním plynu.
Tvoří také různé minerály, jako je antracit, uhlí, lignit a rašelina. Největší důležitost uhlíku spočívá v tom, že tvoří takzvaný „stavební kámen života“ a je přítomen ve všech živých organismech..
Rejstřík článků
- 1 Kde se uhlík nachází a v jaké formě?
- 1.1 Krystalické formy
- 1.2 Amorfní formy
- 1.3 Ropa, zemní plyn a bitumen
- 2 Fyzikální a chemické vlastnosti
- 2.1 Chemický symbol
- 2.2 Atomové číslo
- 2.3 Fyzický stav
- 2.4 Barva
- 2.5 Atomová hmotnost
- 2.6 Teplota tání
- 2.7 Bod varu
- 2.8 Hustota
- 2.9 Rozpustnost
- 2.10 Elektronická konfigurace
- 2.11 Počet elektronů ve vnějším nebo valenčním obalu
- 2.12 Kapacita linky
- 2.13 Katenace
- 3 Biogeochemický cyklus
- 3.1 Fotosyntéza
- 3.2 Dýchání a rozklad
- 3.3 Geologické procesy
- 3.4 Interference z lidské činnosti
- 4 použití
- 4.1 Ropa a zemní plyn
- 4.2 Grafit
- 4,3 Diamond
- 4.4 Antracit
- 4.5 Uhlí
- 4.6 Lignit
- 4.7 Rašelina
- 5 Reference
Kde se uhlík nachází a v jaké formě?
Kromě toho, že je uhlík v přírodě běžnou chemickou složkou ve všech formách života, je přítomen ve třech krystalických formách: diamant, grafit a fulleren..
Existuje také několik amorfních minerálních forem uhlí (antracit, lignit, uhlí, rašelina), kapalné formy (odrůdy oleje) a plynné (zemní plyn).
Krystalické formy
V krystalických formách se atomy uhlíku spojují a vytvářejí uspořádané vzory s geometrickým prostorovým uspořádáním.
Grafit
Je to měkká černá pevná látka s kovovým leskem nebo leskem a tepelně odolná (žáruvzdorná). Jeho krystalická struktura představuje atomy uhlíku spojené v šestihranných prstencích, které se zase spojují ve formujících se deskách.
Vklady grafitu jsou vzácné a byly nalezeny v Číně, Indii, Brazílii, Severní Koreji a Kanadě..
diamant
Je to velmi tvrdá pevná látka, průhledná pro průchod světla a mnohem hustší než grafit: hodnota hustoty diamantu je téměř dvojnásobná než u grafitu.
Atomy uhlíku v diamantu jsou spojeny do čtyřboké geometrie. Podobně je diamant tvořen z grafitu vystaveného podmínkám velmi vysokých teplot a tlaků (3000 ° C) °C a 100 000 atm).
Většina diamantů se nachází mezi 140 až 190 km hluboko v plášti. Prostřednictvím hlubokých sopečných erupcí je magma může transportovat na vzdálenosti blízko povrchu.
Vklady diamantů jsou v Africe (Namibie, Ghana, Demokratická republika Kongo, Sierra Leone a Jižní Afrika), Americe (Brazílie, Kolumbie, Venezuela, Guyana, Peru), Oceánii (Austrálie) a Asii (Indie).

Fullereny
Jsou to molekulární formy uhlíku, které tvoří shluky 60 a 70 atomů uhlíku v téměř sférických molekulách, podobně jako fotbalové míče..
Existují také menší fullereny s 20 atomy uhlíku. Některé formy fullerenů zahrnují uhlíkové nanotrubice a uhlíková vlákna..

Amorfní formy
V amorfních formách se atomy uhlíku nespojují a tvoří uspořádanou a pravidelnou krystalickou strukturu. Místo toho dokonce obsahují nečistoty z jiných prvků.
Antracit
Je to nejstarší metamorfované minerální uhlí (které pochází z modifikace hornin působením teploty, tlaku nebo chemického působení tekutin), protože jeho vznik se datuje od primární nebo paleozoické doby, období karbonu.
Antracit je amorfní forma uhlíku s nejvyšším obsahem tohoto prvku: mezi 86 a 95%. Je šedočerné barvy s kovovým leskem a je těžký a kompaktní..
Antracit se obecně vyskytuje v zónách geologické deformace a představuje přibližně 1% světových zásob uhlí..
Geograficky se vyskytuje v Kanadě, USA, Jižní Africe, Francii, Velké Británii, Německu, Rusku, Číně, Austrálii a Kolumbii.

Uhlí
Jedná se o minerální uhlí, sedimentární horninu organického původu, jejíž vznik se datuje do období prvohor a druhohor. Má obsah uhlíku mezi 75 a 85%.
Je černé barvy, která se vyznačuje tím, že je neprůhledná a má matný a mastný vzhled, protože má vysoký obsah živičných látek. Vzniká lisováním lignitu v prvohorách, v karbonu a permu.
Je to nejhojnější forma uhlíku na planetě. Ve Spojených státech, Velké Británii, Německu, Rusku a Číně jsou velké zásoby uhlí.
Hnědé uhlí
Jedná se o minerální fosilní uhlí vzniklé v třetihorách z rašeliny lisováním (vysokými tlaky). Má nižší obsah uhlíku než uhlí, mezi 70 a 80%.
Je to materiál, který není příliš kompaktní, drobivý (charakteristika, která ho odlišuje od ostatních uhlíkových minerálů), hnědý nebo černý. Jeho struktura je podobná jako u dřeva a jeho obsah uhlíku se pohybuje od 60 do 75%.
Jedná se o snadno vznětlivé palivo s nízkou výhřevností a nižším obsahem vody než rašelina..
V Německu, Rusku, České republice, Itálii (regiony Veneto, Toskánsko, Umbrie) a Sardinii jsou významné hnědé uhlí. Ve Španělsku jsou ložiska hnědého uhlí v Asturii, Andoře, Zaragoze a La Coruñě.
Rašelina
Jedná se o materiál organického původu, jehož vznik pochází z kvartérní doby, mnohem novější než předchozí uhlí.
Je hnědavě žluté barvy a objevuje se ve formě houbovité hmoty s nízkou hustotou, ve které můžete vidět zbytky rostlin z místa, odkud pochází..
Na rozdíl od uhlí výše uvedeného nepochází rašelina z procesů karbonizace dřevního materiálu nebo dřeva, ale byla vytvořena akumulací rostlin - hlavně trav a mechů - v bažinatých oblastech prostřednictvím procesu karbonizace, který nebyl dokončen..
Rašelina má vysoký obsah vody; z tohoto důvodu vyžaduje před použitím sušení a zhutnění.
Má nízký obsah uhlíku (pouze 55%); proto má nízkou energetickou hodnotu. Při spalování jsou jeho zbytky popela hojné a vyzařují velké množství kouře.
Významná ložiska rašeliny jsou v Chile, Argentině (Tierra del Fuego), Španělsku (Espinosa de Cerrato, Palencia), Německu, Dánsku, Holandsku, Rusku, Francii.

Ropa, zemní plyn a bitumen
Olej (z latiny petrae, což znamená „kámen“; Y oleum, což znamená „olej“: „kamenný olej“) je směs mnoha organických sloučenin - nejvíce uhlovodíků - vyráběných anaerobním bakteriálním rozkladem (v nepřítomnosti kyslíku) organických látek.
Byl vytvořen v podloží, ve velkých hloubkách a za zvláštních podmínek jak fyzikálních (vysoké tlaky a teploty), tak chemických (přítomnost specifických katalytických sloučenin) v procesu, který trval miliony let.
Během tohoto procesu se C a H uvolňovaly z organických tkání a znovu se spojily, aby se vytvořilo obrovské množství uhlovodíků, které se mísí podle svých vlastností a tvoří zemní plyn, olej a bitumen..
Ropná pole planety se nacházejí hlavně ve Venezuele, Saúdské Arábii, Iráku, Íránu, Kuvajtu, Spojených arabských emirátech, Rusku, Libyi, Nigérii a Kanadě.
Zásoby zemního plynu existují mimo jiné v Rusku, Íránu, Venezuele, Kataru, Spojených státech, Saúdské Arábii a Spojených arabských emirátech.
Fyzikální a chemické vlastnosti
Z vlastností uhlíku můžeme zmínit následující:
Chemický symbol
C.
Protonové číslo
6.
Fyzický stav
Pevná látka, za normálních tlakových a teplotních podmínek (1 atmosféra a 25 ° C) °C).
Barva
Šedá (grafitová) a průhledná (diamantová).
Atomová hmotnost
12,011 g / mol.
Bod tání
500 °C.
Bod varu
827 °C.
Hustota
2,62 g / cm3.
Rozpustnost
Nerozpustný ve vodě, rozpustný v CCl tetrachlormethanu4.
Elektronická konfigurace
1 sdva 2 sdva 2 strdva.
Počet elektronů ve vnějším nebo valenčním plášti
4.
Kapacita spojení
4.
Katenace
Má schopnost tvořit chemické sloučeniny v dlouhých řetězcích.
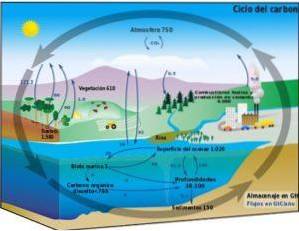
Biogeochemický cyklus
Uhlíkový cyklus je biogeochemický kruhový proces, jehož prostřednictvím lze uhlík směňovat mezi suchozemskou biosférou, atmosférou, hydrosférou a litosférou..
Znalost tohoto cyklického procesu uhlíku na Zemi nám umožňuje demonstrovat lidskou akci v tomto cyklu a jeho důsledky pro globální změnu klimatu.
Uhlík může cirkulovat mezi oceány a jinými vodními plochami, jakož i mezi litosférou, v půdě a podloží, v atmosféře a v biosféře. V atmosféře a hydrosféře existuje uhlík v plynné formě jako COdva (oxid uhličitý).
Fotosyntéza
Uhlík z atmosféry je zachycen suchozemskými a vodními organismy produkujícími ekosystémy (fotosyntetické organismy).
Fotosyntéza umožňuje chemickou reakci mezi COdva a vodu zprostředkovanou sluneční energií a chlorofylem z rostlin za účelem produkce sacharidů nebo cukrů. Tento proces transformuje jednoduché molekuly s nízkým energetickým obsahem COdva, HdvaO a kyslík Odva, ve složitých vysokoenergetických molekulárních formách, kterými jsou cukry.
Heterotrofní organismy - které nemohou fotosyntetizovat a jsou spotřebiteli v ekosystémech - získávají uhlík a energii krmením producentů a dalších spotřebitelů.
Dýchání a rozklad
Dýchání a rozklad jsou biologické procesy, které uvolňují uhlík do životního prostředí ve formě COdva nebo CH4 (methan vyrobený v anaerobním rozkladu; to znamená v nepřítomnosti kyslíku).
Geologické procesy
Prostřednictvím geologických procesů a v důsledku plynutí času může být uhlík z anaerobního rozkladu přeměněn na fosilní paliva, jako je ropa, zemní plyn a uhlí. Stejně tak je uhlík také součástí jiných minerálů a hornin.
Interference z lidské činnosti
Když člověk využívá spalování fosilních paliv na energii, uhlík se vrací do atmosféry v podobě obrovského množství CO.dva které nelze asimilovat přirozeným biogeochemickým uhlíkovým cyklem.
Tento přebytek COdva produkovaný lidskou činností negativně ovlivňuje rovnováhu uhlíkového cyklu a je hlavní příčinou globálního oteplování.
Aplikace
Použití uhlíku a jeho sloučenin je extrémně rozmanité. Nejvýznamnější s následujícími:
Ropa a zemní plyn
Hlavní ekonomické využití uhlíku představuje jeho použití jako uhlovodíku na fosilní paliva, jako je metan a ropa.
Ropa se destiluje v rafinériích za účelem získání různých derivátů, jako je benzín, nafta, petrolej, asfalt, maziva, rozpouštědla a další, které se zase používají v petrochemickém průmyslu, který vyrábí suroviny pro průmysl plastů, hnojiv, léčiv a barev., mimo jiné.
Grafit
Grafit se používá v následujících akcích:
- Používá se při výrobě tužek ve směsi s jíly.
- Je součástí výroby žáruvzdorných cihel a kelímků odolných vůči teplu.
- V různých mechanických zařízeních, jako jsou podložky, ložiska, písty a těsnění.
- Je to vynikající tuhé mazivo.
- Vzhledem ke své elektrické vodivosti a chemické inertnosti se používá při výrobě elektrod, uhlíků pro elektromotory..
- Používá se jako moderátor v jaderných elektrárnách.
diamant
Diamant má obzvláště výjimečné fyzikální vlastnosti, jako je dosud známý nejvyšší stupeň tvrdosti a tepelné vodivosti.
Tyto vlastnosti umožňují průmyslové aplikace nástrojů používaných k výrobě řezů a nástrojů pro leštění díky vysoké abrazivitě..
Jeho optické vlastnosti - například průhlednost a schopnost rozkládat bílé světlo a lámat světlo - mu dávají mnoho aplikací v optických nástrojích, například při výrobě čoček a hranolů..
Charakteristický lesk odvozený z jeho optických vlastností je také vysoce ceněn v klenotnickém průmyslu..
Antracit
Antracit je obtížné zapálit, pomalu hoří a vyžaduje hodně kyslíku. Jeho spalování produkuje malý bledomodrý plamen a vydává hodně tepla.
Před několika lety se antracit používal v termoelektrických zařízeních a pro vytápění domácností. Jeho použití má výhody, jako je tvorba malého popela nebo prachu, malého kouře a pomalý proces spalování..
Vzhledem k vysokým ekonomickým nákladům a jeho nedostatku byl antracit nahrazen zemním plynem v termoelektrických zařízeních a elektřinou v domácnostech.
Uhlí
Uhlí se používá jako surovina k získání:
- Koks, palivo pro vysoké pece v ocelárnách.
- Kreosot, získaný smícháním dehtových destilátů z uhlí a použitý jako ochranný tmel pro dřevo vystavené povětrnostním vlivům.
- Krezol (chemicky methylfenol) extrahovaný z uhlí a používaný jako dezinfekční a antiseptický prostředek,
- Jiné deriváty, jako je plyn, dehet nebo smola, a sloučeniny používané při výrobě parfémů, insekticidů, plastů, barev, pneumatik a vozovek, mimo jiné.
Hnědé uhlí
Lignit představuje palivo střední kvality. Jet, odrůda hnědého uhlí, se vyznačuje tím, že je velmi kompaktní díky dlouhému procesu karbonizace a vysokým tlakům a používá se v klenotnictví a zdobení.
Rašelina
Rašelina se používá v následujících činnostech;
- Pro růst, podporu a transport rostlinných druhů.
- Jako organický kompost.
- Jako zvířecí podestýlky ve stájích.
- Jako palivo nízké kvality.
Reference
- Burrows, A., Holman, J., Parsons, A., Pilling, G. and Price, G. (2017). Chemistry3: Introduction an Anorganic, Organic and Physical Chemistry. Oxford University Press.
- Deming, A. (2010). Král živlů? Nanotechnologie. 21 (30): 300201. doi: 10,1088
- Dienwiebel, M., Verhoeven, G., Pradeep, N., Frenken, J., Heimberg, J. a Zandbergen, H. (2004). Superlubricita grafitu. Dopisy o fyzické kontrole. 92 (12): 126101. doi: 10.1103
- Irifune, T., Kurio, A., Sakamoto, S., Inoue, T. a Sumiya, H. (2003). Materiály: Velmi tvrdý polykrystalický diamant z grafitu. Příroda. 421 (6923): 599-600. doi: 10.1038
- Savvatimskiy, A. (2005). Měření bodu tání grafitu a vlastností kapalného uhlíku (přehled pro roky 1963-2003). Uhlí. 43 (6): 1115. doi: 10,1016



Zatím žádné komentáře