
Struktura, vlastnosti a použití kyseliny chlorovodíkové (HCl)

The kyselina chlorovodíková (HCl) nebo kyselina muriatová je anorganická sloučenina, která vzniká rozpuštěním chlorovodíku ve vodě za vzniku hydroniového iontu (H3NEBO+) a chloridový ion (Cl-). Přesněji řečeno, jde o hydracid halogenového chloru s vodíkem.
HCl je silná kyselina, která zcela ionizuje ve vodě a její ionizační produkty jsou stabilní. Kompletní ionizace HCl je potvrzena skutečností, že pH 0,1 M roztoku HCl je 1.

Hlavní metodou průmyslové výroby HCl je chlorace organických sloučenin za vzniku například dichlormethanu, trichlorethylenu, perchlorethylenu nebo vinylchloridu. HCl je vedlejším produktem chlorační reakce.
Používá se při titraci bází při mnoha chemických reakcích, při chemické digesci organických sloučenin atd..
Výpary kyseliny chlorovodíkové (chlorovodík) mohou vážně poranit oči. Kromě toho mohou způsobit podráždění a vážné problémy s dýchacími cestami.
Lumen žaludku má kyselé pH (1-3) s vysokou koncentrací HCl. Přítomnost kyseliny upřednostňuje sterilizaci obsahu žaludku a inaktivuje řadu bakterií přítomných v potravinách. To by vysvětlovalo gastroenteritidu spojenou se stavem achlorhydrie.
Kromě toho HCl usnadňuje trávení bílkovin aktivací proteolytického enzymu pepsinu..
Používá se při čištění bazénů, obvykle stačí běžný čisticí prostředek, ale mezi dlaždicemi ulpívají skvrny, které v těchto případech vyžadují použití kyseliny chlorovodíkové..
Používá se při regulaci pH ve farmaceutických, potravinářských a pitných vodách. Používá se také k neutralizaci odpadních toků obsahujících alkalický materiál..
Kyselina chlorovodíková se používá k regeneraci iontoměničových pryskyřic, která se používá k sekvestraci kovových iontů nebo jiných typů iontů v průmyslu, ve výzkumných laboratořích a při čištění pitné vody..
Na druhou stranu lze také poznamenat, že chlorovodík, plynná sloučenina, je diatomická molekula a atomy, které ji tvoří, jsou spojeny kovalentní vazbou. Mezitím je kyselina chlorovodíková iontová sloučenina, která se ve vodném roztoku disociuje na H+ a Cl-. Interakce mezi těmito ionty je elektrostatická..
Rejstřík článků
- 1 Chemická struktura
- 2 Školení
- 3 Kde se nachází?
- 3.1 Gastrin
- 3,2 histamin
- 3.3 Acetylcholin
- 3.4 Další zdroje biologického HCl
- 4 Fyzikální a chemické vlastnosti
- 4.1 Molekulová hmotnost
- 4.2 Barva
- 4.3 Zápach
- 4.4 Příchuť
- 4.5 Bod varu
- 4.6 Teplota tání
- 4.7 Rozpustnost ve vodě
- 4.8 Rozpustnost v methanolu
- 4.9 Rozpustnost v ethanolu
- 4.10 Rozpustnost v etheru
- 4.11 Hustota
- 4.12 Hustota plynu
- 4.13 Hustota par
- 4.14 Tlak par
- 4.15 Stabilita
- 4.16 Samovznícení
- 4.17 Rozklad
- 4.18 Žíravost
- 4.19 Povrchové napětí
- 4.20 Polymerizace
- 5 použití
- 5.1 Průmyslové a domácí
- 5.2 Syntéza a chemické reakce
- 6 Rizika a toxicita
- 7 Prevence poškození kyselinou chlorovodíkovou
- 8 Reference
Chemická struktura
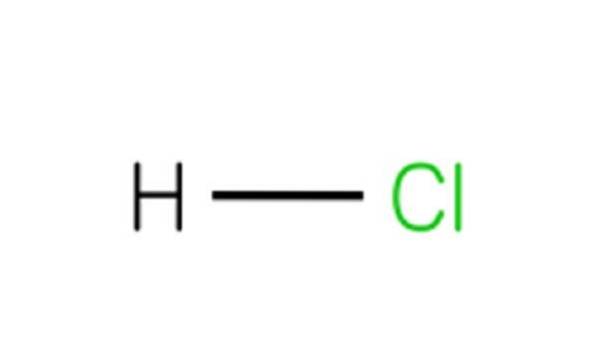
Každá molekula HCl je tvořena atomem vodíku a atomem chloru. I když je HCl při pokojové teplotě jedovatý a bezbarvý plyn, pokud se rozpustí ve vodě, poskytne kyselinu chlorovodíkovou..
Výcvik

-Může být vyroben elektrolýzou NaCl (chlorid sodný), z něhož pochází Hdva (g), Cldva (g), 2Na (ac) a OH- (ac). Později:
Hdva + Cldva => 2 HCl
Toto je exotermická reakce.
-HCl se vyrábí reakcí chloridu sodného s kyselinou sírovou. Proces, který lze popsat následujícím způsobem:
NaCl + HdvaSW4 => NaHSO4 + HCl
Dále se zachytí chlorovodík a chlorid sodný se nechá reagovat s hydrogensiřičitanem sodným podle následující reakce:
NaCl + NaHSO4 => NadvaSW4 + HCl
Tuto reakci zavedl Johan Glauber v 17. století za vzniku kyseliny chlorovodíkové. V současné době se používá hlavně v laboratořích, protože význam jeho průmyslového využití klesl.
-Kyselinu chlorovodíkovou lze vyrábět jako vedlejší produkt chlorace organických sloučenin, například: při výrobě dichlormethanu.
CdvaH4 + Cldva => C.dvaH4Cldva
CdvaH4Cldva => C.dvaH3Cl + HCl
Tato metoda výroby HCl se více používá průmyslově, počítá se, že 90% HCl produkovaného ve Spojených státech je podle této metodiky.
-A nakonec se HCl vyrábí při spalování chlorovaného organického odpadu:
C4H6Cldva + 5 O.dva => 4 COdva + 2 hdvaO + 2 HCl
Kde se to nachází?
Kyselina chlorovodíková je koncentrována v lumen žaludku, kde je dosaženo pH 1. Existence hlenové bariéry bohaté na hydrogenuhličitan, zabraňuje poškození žaludečních buněk v důsledku nízkého žaludečního pH..
Existují tři hlavní fyziologické podněty pro sekreci H+ parietálními buňkami žaludečního těla: gastrin, histamin a acetylcholin.
Gastrin
Gastrin je hormon, který se vylučuje v oblasti žaludečního antra a působí zvýšením intracelulární koncentrace Ca, což je prostředník při aktivaci aktivního transportu H+ směrem k lumen žaludku.
Aktivní transport provádí enzym ATPáza, který využívá energii obsaženou v ATP k přenosu H+ směrem k lumen žaludku a zavést K.+.
Histamin
Je vylučován takzvanými enterochromafinovými buňkami (SEC) žaludečního těla. Jeho působení je zprostředkováno zvýšením koncentrace cyklického AMP a působí zvýšením aktivního transportu H, jako je gastrin.+ směrem k lumen žaludku zprostředkovanému H-pumpou+-K.+.
Acetylcholin
Vylučuje se vagovými nervovými zakončeními, stejně jako gastrin zprostředkovává jeho působení zvýšením intracelulárního Ca a aktivuje působení H pumpy.+-K.+.
H+ parietálních buněk pochází z reakce COdva s H.dvaO za vzniku HdvaCO3 (kyselina uhličitá). To se později rozloží na H+ a HCO3-. H+ je aktivně transportován do lumen žaludku žaludeční apikální membránou. Mezitím HCO3- je přiveden do krve spojený se vstupem Cl-.
Proti transportní nebo anti-transportní mechanismus Cl-HCO3- který se vyskytuje v bazální membráně parietálních buněk, produkuje intracelulární akumulaci Cl-. Následně iont prochází do lumen žaludku doprovázejícího H+. Odhaduje se, že žaludeční sekrece HCl má koncentraci 0,15 M.
Další zdroje biologického HCl
Existují i další podněty pro vylučování HCl parietálními buňkami, jako je kofein a alkohol.
Žaludeční a duodenální vředy se objevují, když je narušena bariéra, která chrání žaludeční buňky před škodlivým působením HCl..
Odstraněním výše uvedeného ochranného účinku přispívají bakterie Helicobacter pylori, kyselina acetylsalicylová a nesteroidní protizánětlivé léky (NSAID) k tvorbě vředů..
Sekrece kyselin má funkci eliminace mikrobů přítomných v potravinách a zahájení trávení bílkovin působením pepsinu. Hlavní buňky žaludečního těla vylučují pepsinogen, proenzym, který se transformuje na pepsin nízkým pH lumen žaludku.
Fyzikální a chemické vlastnosti
Molekulární váha
36,458 g / mol.
Barva
Je to bezbarvá nebo slabě nažloutlá kapalina.
Zápach
Je to dráždivý štiplavý zápach.
Chuť
Prahová hodnota pro ochutnávku je čistá voda je koncentrace 1,3 x 10-4 krtci / l.
Bod varu
-121 ° F při 760 mmHg. -85,05 ° C až 760 mmHg.
Bod tání
-174 ° F (-13,7 ° F) pro 39,7% hmotn./hmotn. Roztok HCl ve vodě), -114,22 ° C.
Rozpustnost ve vodě
Roztok HC1 může být 67% hmotn./hmotn. Při 86 ° F; 82,3 g / 100 g vody při 0 ° C; 67,3 g / 100 g vody při 30 ° C a 63,3 g / 100 g vody při 40 ° C.
Rozpustnost v methanolu
51,3 g / 100 g roztoku při 0 ° C a 47 g / 100 roztoku při 20 ° C
Rozpustnost v ethanolu
41,0 / 100 g roztoku při 20 ° C
Rozpustnost v etheru
24,9 g / 100 roztoku při 20 ° C.
Hustota
1,059 g / ml při 59 ° F v 10,17% hmotn./hmotn. Roztoku.
Hustota plynu
1 00045 g / l
Hustota par
1268 (ve vztahu ke vzduchu odebranému jako 1)
Tlak páry
32 452 mmHg při 70 ° F; 760 mmHg při -120,6 ° F
Stabilita
Má vysokou tepelnou stabilitu.
Samovznícení
Není hořlavý.
Rozklad
Rozkládá se na topení a vydává toxický chlórový kouř.
Viskozita: 0,405 cPoise (kapalina při 118,6 ° K), 0,0131 cPoise (pára při 273,06 ° K).
Žíravost
Je vysoce korozivní pro hliník, měď a nerezovou ocel. Útočí na všechny kovy (rtuť, zlato, platina, stříbro, tantal, kromě určitých slitin).
Povrchové napětí
23 mN / cm při 118,6 ° K.
Polymerizace
Aldehydy a epoxidy procházejí prudkou polymerací v přítomnosti kyseliny chlorovodíkové.
Fyzikální vlastnosti, jako je viskozita, tlak par, teplota varu a teplota tání, jsou ovlivněny procentuální koncentrací HCl.
Aplikace
Kyselina chlorovodíková má mnoho využití doma, v různých průmyslových odvětvích, ve výukových a výzkumných laboratořích atd..
Průmyslové a domácí
-Kyselina chlorovodíková se používá při hydrometalurgickém zpracování, například při výrobě oxidu hlinitého a oxidu titaničitého. Používá se při aktivaci těžby ropných vrtů.
Vstřikování kyseliny zvyšuje pórovitost kolem oleje, což podporuje jeho extrakci..
-Používá se k odstraňování usazenin CaCO3 (uhličitan vápenatý) jeho přeměnou na CaCldva (chlorid vápenatý), který je rozpustnější a snáze odstranitelný. Podobně se průmyslově používá při zpracování oceli, materiálu s mnoha využitími a aplikacemi, jak v průmyslu, ve stavebnictví, tak v domácnosti..
-Zedníci používají k mytí a čištění cihel roztoky HCl. Používá se v domácnosti k čištění a dezinfekci koupelen a jejich odtoků. Kromě toho se kyselina chlorovodíková používá při rytích, včetně čištění kovů..
-Kyselina chlorovodíková má uplatnění při eliminaci plesnivé vrstvy oxidu železa, která se hromadí na oceli, před jejím následným zpracováním při vytlačování, válcování, galvanizaci atd..
VíradvaNEBO3 + Fe + 6 HCl => 3 FeCldva + HdvaNEBO
-Přestože je vysoce korozivní, používá se k odstranění kovových skvrn přítomných v železe, mědi a mosazi za použití ředění 1:10 ve vodě..
Syntéza a chemické reakce
-Kyselina chlorovodíková se používá při titračních reakcích na zásady nebo zásady, jakož i při úpravě pH roztoků. Kromě toho se používá při mnoha chemických reakcích, například při trávení bílkovin, postupu před studiem obsahu aminokyselin a jejich identifikací..
-Primárním použitím kyseliny chlorovodíkové je výroba organických sloučenin, jako je vinylchlorid a dichlormethan. Kyselina je meziproduktem při výrobě polykarbonátů, aktivního uhlí a kyseliny askorbové.
-Používá se při výrobě lepidla. Zatímco v textilním průmyslu se používá při bělení tkanin. Používá se v kožedělném průmyslu a zasahuje do jeho zpracování. Rovněž nachází použití jako hnojivo a při výrobě chloridů, barviv atd. Používá se také v galvanickém pokovování, fotografii a gumárenském průmyslu..
-Používá se při výrobě umělého hedvábí, při rafinaci olejů, tuků a mýdel. Kromě toho se používá při polymeračních, izomeračních a alkylačních reakcích..
Rizika a toxicita
Působí leptavě na kůži a sliznice a způsobuje popáleniny. Pokud jsou závažné, mohou způsobit ulcerace a zanechat keloidní a zatahovací jizvy. Kontakt s očima může způsobit snížení nebo úplnou ztrátu zraku v důsledku poškození rohovky..
Když se kyselina dostane do obličeje, může to způsobit vážné cykly, které znetvořují obličej. Častý kontakt s kyselinou může také způsobit dermatitidu..
Požití kyseliny chlorovodíkové popálí ústa, hrdlo, jícen a gastrointestinální trakt a způsobí nevolnost, zvracení a průjem. V extrémních případech může dojít k perforaci jícnu a střeva se srdeční zástavou a smrtí..
Naproti tomu kyselé páry mohou v závislosti na jejich koncentraci způsobit podráždění dýchacích cest a způsobit faryngitidu, otok hlasivkové tkáně, zúžení průdušek bronchitidou, cyanózu a plicní edém (nadměrné hromadění tekutin v plicích) a v extrémních případech smrt.
Vystavení vysokým hladinám kyselých výparů může způsobit otoky hrdla a křeče s následným udušením..
Časté jsou také zubní nekrózy, které se objevují ve zubech se ztrátou lesku; zbarví nažloutle a kašovitě, nakonec se zlomí.
Prevence poškození kyselinou chlorovodíkovou
Pro bezpečnost lidí pracujících s kyselinou chlorovodíkovou existuje soubor pravidel:
-Lidé s anamnézou respiračních a zažívacích chorob by neměli pracovat v prostředích s přítomností kyselin..
-Pracovníci musí nosit oděv odolný vůči kyselinám, a to i s kapucí; brýle na ochranu očí, chrániče paží, rukavice odolné vůči kyselinám a boty se stejnými vlastnostmi. Měli by také nosit plynové masky a v případě silného vystavení výparům kyseliny chlorovodíkové se doporučuje použít samostatný dýchací přístroj..
-V pracovním prostředí musí být také nouzové sprchy a fontány pro mytí očí..
-Kromě toho existují normy pro pracovní prostředí, jako je typ podlahy, uzavřené obvody, ochrana elektrických zařízení atd..
Reference
- StudiousGuy. (2018). Kyselina chlorovodíková (HCl): Důležitá použití a aplikace. Převzato z: studiousguy.com
- Ganong, W. F. (2003). Recenze lékařské fyziologie. Dvacáté první vydání. Společnosti McGraw-Hill Companies INC.
- PubChem. (2018). Kyselina chlorovodíková. Převzato z: pubchem.ncbi.nlm.nih.gov
- Weebly. Kyselina chlorovodíková. Převzato z: psa-hydrochloric-acid.weebly.com
- CTR. Bezpečnostní list kyseliny chlorovodíkové. [PDF]. Převzato z: uacj.mx


Zatím žádné komentáře