
Struktura kyseliny sulfamové, vlastnosti, syntéza, použití

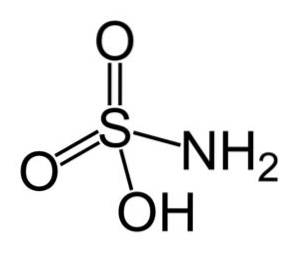
The kyselina sulfamová je anorganická sloučenina tvořená atomem síry (S) kovalentně vázaným a jednoduchou vazbou na hydroxylovou skupinu (-OH) a na aminoskupinu (-NHdva) a dvojnou vazbou na dva atomy kyslíku (O). Je to bílá krystalická pevná látka. Jeho chemický vzorec je NHdvaSW3H. Také známé jako kyselina aminosulfonová, kyselina amidosulfonová, kyselina amidosulfurová a kyselina sulfamidová..
Kyselina sulfamová je silná kyselina. Může reagovat s kovy, oxidy kovů a uhličitany. Jeho soli jsou obecně rozpustné ve vodě, což z něj činí dobrý odstraňovač vodního kamene v procesním zařízení. Často se používá v cukrovarech k čištění usazenin uhličitanu ve výparníkovém zařízení..
Kyselina sulfamová je nitritový reduktor (NOdva-) a tato chemická vlastnost se používá v různých aplikacích, například v průmyslu barviv a při analýze dusitanů..
Používá se při činění kůže a bělení buničiny pro výrobu papíru. Ve skutečnosti jde o kontaminant potravin, protože se často vyskytuje v papírech a lepenkách používaných k balení potravin..
Používá se také při elektrolytickém nanášení kovů jako laboratorní standard a jedním z jeho derivátů je velmi účinný herbicid..
Rejstřík článků
- 1 Struktura
- 2 Názvosloví
- 3 Vlastnosti
- 3.1 Fyzický stav
- 3,2 Molekulová hmotnost
- 3.3 Teplota tání
- 3.4 Hustota
- 3.5 Rozpustnost
- 3,6 pH
- 3.7 Disociační konstanta
- 3.8 Chemické vlastnosti
- 3.9 Další vlastnosti
- 4 Syntéza
- 5 použití
- 5.1 V průmyslu barviv
- 5.2 Při zpracování kůže
- 5.3 Zařízení na čištění
- 5.4 Při rafinaci kovů
- 5.5 Jako standardní činidlo v laboratoři
- 5.6 Při analýze dusitanů
- 5.7 Při analýze rozpuštěného kyslíku ve vodě
- 5.8 Při přípravě oxidu dusného
- 5.9 V zemědělství
- 5.10 Na nehořlavých látkách
- 5.11 V různých aplikacích
- 6 Reference
Struktura
Kyselina sulfamová krystalizuje ve formě dipyramidových ortorombických krystalů. Vytváří kompaktní hranoly a listy při krystalizaci ze studeného roztoku, stejně jako diamantové listy při krystalizaci z horkého vodného roztoku.
Nomenklatura
- Kyselina sulfamová
- Kyselina aminosulfonová
- Kyselina amidosulfonová
- Kyselina amidosírová
- Kyselina sulfamidová
Vlastnosti
Fyzický stav
Bílá krystalická pevná látka.
Molekulární váha
97,1 g / mol.
Bod tání
205 ° C, rozkládá se při 209 ° C.
Hustota
2,15 g / cm3
Rozpustnost
Rozpustný ve vodě:
- 12,8% při 0 ° C
- 17,57% při 20 ° C
- 22,77% při 40 ° C
Mírně rozpustný v methanolu, těžce rozpustný v acetonu, nerozpustný v etheru.
Je snadno rozpustný v dusíkatých bázích a v organických rozpouštědlech obsahujících dusík.
Nerozpustný v sirouhlíku (CSdva) a tetrachlormethan (CCl4).
pH
0,41 (v 1N roztoku, tj. 1 ekvivalent / l).
Disociační konstanta
0,101 při 25 ° C.
Chemické vlastnosti
Je to silná kyselina. Téměř tolik jako kyselina chlorovodíková (HCl), dusičná (HNO3) a sírové (HdvaSW4).
Vodné roztoky kyseliny sulfamové jsou vysoce ionizované. Jeho pH je nižší než u roztoků kyseliny mravenčí, fosforečné a šťavelové.
Ve vodě ztrácí kyselina sulfamová pouze proton, který je vázán na kyslík. Vodíky vázané na dusík drží pevně pohromadě.
Ve vodném roztoku pomalu hydrolyzuje za vzniku kyselého síranu amonného (NH4HSO4). Je stabilní za sucha.
Kyselina sulfamová napadá kovy, oxidy kovů a uhličitany za vzniku sulfamátů. Například s kovem draselným (K) tvoří síran draselný (KOSOdvaNHdva) a vodík (Hdva).
Všechny soli kyseliny sulfamové jsou rozpustné ve vodě. Soli vápníku, olova a barya jsou velmi rozpustné ve vodě, na rozdíl od odpovídajících solí kyseliny sírové.
Kyselina dusitá (HNOdva) kvantitativně reaguje s aminoskupinou kyseliny sulfamové a uvolňuje dusík (Ndva). Odhaduje se, že sulfamátový iont pracuje v této reakci jako amid, nikoli jako amin..
Kyselina sulfamová je oxidována chlorem, bromem nebo chlorečnanem draselným, aby se přeměnila na kyselinu sírovou. K této reakci nedochází u jiných oxidantů, jako je kyselina chromová nebo manganistan draselný..
Není kompatibilní (reaguje) se silnými alkáliemi, chlórem, kyselinou chlornou, chlornany, kyanidy a sulfidy.
Další vlastnosti
Není hygroskopický (to znamená, že neabsorbuje vlhkost ze vzduchu).
Při zahřátí na rozklad vydává vysoce toxické výpary oxidů síry a chlorovodíku (HCl).
Jeden z jeho derivátů, síran amonný, zpomaluje hoření.
Je mírně toxický.
Syntéza
Kyselina sulfamová se získává reakcí močoviny CO (NHdva)dva s dýmavou kyselinou sírovou, tj. kyselinou sírovou (HdvaSW4) koncentrát obsahující oxid sírový (SO3).
Může být také syntetizován reakcí kyseliny chlorosulfonové (HClO3Cl) a amoniak (NH3).
Aplikace
V průmyslu barviv
Kyselina sulfamová se používá k rychlému a účinnému odstranění přebytečných dusitanů při diazotačních reakcích při syntéze barviv. Pro tento účel je to mnohem praktičtější než močovina.
Při zpracování kůže
Během činění kůže poskytuje použití kyseliny sulfamové místo kyseliny sírové jemnější a hedvábnou strukturu.
Jelikož je sulfamát vápenatý rozpustný ve vodě, na rozdíl od síranu vápenatého lze při oddělovacím procesu použít kyselinu sulfamovou, aniž by při používání kyseliny sírové zůstaly skvrny, které se někdy vyskytují na kůži..

V zařízení na čištění
Kyselina sulfamová se používá jako prostředek k odstraňování vodního kamene v konvicích, reaktorech, potrubích, chladicích systémech a tepelných výměnících.
V tomto zařízení se usazeniny vytvářejí cirkulací vody nebo procesních sloučenin v elektrárnách, chemických závodech, ocelárnách, papírnách, kompresorech a dalších průmyslových odvětvích..
Váhy nebo pevné usazeniny mohou být organické (řasy, bahno, houby) nebo anorganické (oxidy železa, sulfidy železa, uhličitany vápenaté nebo hořečnaté, sírany, fosfáty nebo křemičitany).
Kyselina sulfamová je velmi účinná při odstraňování vodního kamene z uhličitanu vápenatého. Může být použit na mědi, mosazi, nerezové oceli, litině a pozinkované oceli.
Používá se ve formě 5 až 10% hmotnostních roztoku. Používá se zejména v cukrovarech k čištění výparníků z litiny měděnými tepelnými výměníky.

Mělo by se používat při teplotách ne vyšších než 50-60 ° C. Teploty 70 ° C vedou k tvorbě nerozpustných síranů, jako je CaSO4.
Při použití v kombinaci s chloridem sodným dochází k synergickému účinku a roztok umožňuje pomalé rozpouštění oxidu železitého. V tomto případě by neměl být používán s nerezovou ocelí, protože se uvolňuje kyselina chlorovodíková, která může způsobit korozi v tomto materiálu..
Při rafinaci kovů
Galvanické pokovování kovů, jako je měď, stříbro, kobalt, nikl, zinek, kadmium, železo a olovo, lze úspěšně provádět v roztocích kyseliny sulfamové. To lze zvládnout mnohem snadněji než s kyselinou fluorovodíkovou (HdvaSiF6).
Jako standardní činidlo v laboratoři
Vzhledem k určitým charakteristikám kyseliny sulfamové, jako jsou: její síla jako kyselina, snadnost čištění rekrystalizací ve vodě, její stabilita a nehygroskopičnost, se používá jako primární standard na laboratorní úrovni. To znamená, že se používá pro kvantitativní stanovení alkálií..

Při analýze dusitanů
Kvůli snadné reakci s dusitany se k jejich stanovení v roztoku používá kyselina sulfamová..
Při analýze rozpuštěného kyslíku ve vodě
Jelikož kyselina sulfamová reaguje s dusitany ve vodě, uvolňuje se dusík, je možné provádět stanovení rozpuštěného kyslíku ve vodě, protože je eliminováno rušení způsobené dusitany..
Při přípravě oxidu dusného
Kyselina sulfamová reaguje s kyselinou dusičnou za vzniku oxidu dusného (NdvaNEBO). Tato reakce je pro získání tohoto plynu bezpečnější než reakce dusičnanu amonného.
V zemědělství
Derivát kyseliny sulfamové, amoniumsulfamát, je účinným netoxickým herbicidem pro zvířata.
Nanáší se rosou na listy druhů, které mají být odstraněny na konci léta nebo počátkem podzimu, nejlépe za vlhkého počasí. Jak sloučenina cestuje z listů do kořenů, rostlina umírá.

Další výhodou této sloučeniny je, že trvale nesterilizuje půdu. Část dusíku ze sulfamátu amonného bude v půdě skutečně k dispozici pro růst rostlin v příští sezóně..
V ohnivzdorných tkaninách
Jeho kompatibilita s celulózou a jeho vlastnosti zpomalující hoření činí ze síranu amonného činidlo pro získávání ohnivzdorných tkanin a papíru..
Používá se na 10% hmotnosti látky, jejíž vzhled a dotek zůstávají nezměněny. Tkanina, která se používá, by měla být chemicky čištěna, nikdy nemyta vodou, aby se nerozpustil sulfamát.
To je užitečné zejména na divadelních oponách nebo podobných místech.

V různých aplikacích
Používá se jako katalyzátor při některých chemických reakcích, například při přípravě močovino-formaldehydových pryskyřic. Je také užitečný jako baktericid a stabilizátor chloru v bazénech a jako bělidlo na dřevnou buničinu v celulózkách a papírnách..
Reference
- NÁS. Národní lékařská knihovna. (2019). Kyselina sulfamová. Obnoveno z pubchem.ncbi.nlm.nih.gov
- Williams, D.L.H. (2004) Nitrosace v dusíkových centrech. In Nitrosation Reactions and the Chemistry of Nitric Oxid. Kapitola 2. Obnoveno ze sciencedirect.com
- Clapp, Leallyn B. (1943). Kyselina sulfamová a její použití. Chem. Educ. 1943, 20, 4, 189. Obnoveno z pubs.acs.org
- McDonald, James. (2003). Kyselina sulfamová. Obnoveno z veoliawatertech.com
- Sastri, V.S. (2010). Řízení a kontrola koroze. V Shreirově korozi. Obnoveno ze sciencedirect.com
- Pratima Bajpai. (2018). Různá témata. In Biermann's Handbook of Pulp and Paper. Třetí edice. Obnoveno ze sciencedirect.com



Zatím žádné komentáře