
Struktura, vlastnosti, rizika a použití kyseliny jodové (HIO3)

The kyselina jodičná je anorganická sloučenina vzorce HIO3. Jedná se o kyselinu jodovou oxokyselinu, která má v této molekule oxidační stav +5. Tato sloučenina je velmi silná kyselina a často se používá ke standardizaci roztoků slabých a silných bází k jejich přípravě pro titraci..
Vzniká oxidací diatomic jodu kyselinou dusičnou, chlorem, peroxidem vodíku nebo kyselinou chlorovodíkovou, jak je znázorněno v následující reakci: Idva + 6HdvaO + 5CIdva ⇌ 2HIO3 + 10HCl.
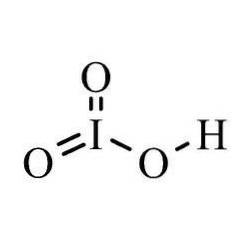
V každé reakci ztrácí křemelina jod elektrony a tvoří komplex s vodíkem a kyslíkem. Díky svým iontovým a rozpustným vlastnostem je iontová kyselina také velmi silnou kyselinou..
Rejstřík článků
- 1 Fyzikální a chemické vlastnosti kyseliny jodové
- 2 Reaktivita a nebezpečí
- 3 Použití a přínosy pro zdraví
- 4 Odkazy
Fyzikální a chemické vlastnosti kyseliny jodové
Kyselina jodová je při teplotě místnosti bílá pevná látka (Royal Society of Chemistry, 2015).

Kyselina jodová má molekulovou hmotnost 175,91 g / mol a hustotu 4,62 g / ml. Je velmi rozpustný ve vodě a je schopen rozpustit 269 gramů kyseliny na 100 ml. Jeho teplota tání je 110 stupňů Celsia, kde začíná rozkladat dehydrataci na oxid jodnatý.
S následným zahříváním sloučeniny na vyšší teplotu se rozkládá za vzniku směsi jódu, kyslíku a nižších oxidů jódu (National Center for Biotechnology Information, S.F.).
Je to relativně silná kyselina s kyselostí 0,75. Jodový nebo jodidový iont je produktem této sloučeniny, když je oxidována. Při velmi nízkém pH a vysoké koncentraci chloridových iontů se redukuje na chlorid jodný, což je žlutá sloučenina v roztoku.
Reaktivita a nebezpečí
Kyselina jodová je za běžných podmínek stabilní sloučenina. Jelikož je silnou kyselinou, je extrémně nebezpečný při kontaktu s pokožkou (žíravý a dráždivý), při kontaktu s očima (dráždivý) a při požití. Kromě toho je velmi nebezpečný také při vdechování (IODIC ACID, S.F.).
Velikost poškození tkáně závisí na délce kontaktu. Kontakt s očima může mít za následek poškození rohovky nebo slepotu. Kontakt s pokožkou může způsobit zánět a puchýře. Vdechování prachu způsobí podráždění gastrointestinálního nebo dýchacího traktu, které je charakterizováno spálením, kýcháním a kašláním..
Silné nadměrné vystavení může způsobit poškození plic, udušení, ztrátu vědomí nebo smrt. Dlouhodobá expozice může způsobit popáleniny a ulcerace kůže. Nadměrná expozice vdechováním může způsobit podráždění dýchacích cest..
Zánět oka je charakterizován zarudnutím, slzením a svěděním. Zánět kůže je charakterizován svěděním, olupováním, zarudnutím nebo občasnými puchýři.
Látka je toxická pro ledviny, plíce a sliznice.
Opakovaná nebo dlouhodobá expozice látce může způsobit poškození těchto orgánů a podráždění očí. Pravidelné vystavování pokožce může způsobit lokální destrukci kůže nebo dermatitidu..
Opakované vdechování prachu může způsobit různé stupně podráždění dýchacích cest nebo poškození plic. Dlouhodobé vdechování prachu může způsobit chronické podráždění dýchacích cest..
V případě kontaktu s očima zkontrolujte, zda nosíte kontaktní čočky, a ihned je vyjměte. Oči by měly být vyplachovány tekoucí vodou po dobu nejméně 15 minut, víčka by měla být otevřená, aby bylo možné používat studenou vodu. Oční mast by se neměla používat.
Pokud chemikálie přijde do styku s oděvem, co nejdříve ji odstraňte, abyste si chránili ruce a tělo. Umístěte postiženého pod bezpečnostní sprchu.
Pokud se chemikálie hromadí na exponované pokožce oběti, například na rukou, kontaminovaná kůže se jemně a opatrně omyje tekoucí vodou a neabrazivním mýdlem. Pokud podráždění přetrvává, vyhledejte lékařskou pomoc a před opětovným použitím vyperte kontaminovaný oděv..
Pokud je kontakt s pokožkou silný, měl by být omyt dezinfekčním mýdlem a kontaminovanou pokožku překrýt antibakteriálním krémem..
V případě vdechnutí by měl být postižený ponechán v klidu na dobře větraném místě. Je-li vdechnutí těžké, měla by být postižená osoba co nejdříve evakuována na bezpečné místo a uvolněn těsný oděv (límeček košile, opasky nebo kravata)..
Pokud postižený dýchá obtížně, měl by být podán kyslík. V krajním případě nedýchání se provádí resuscitace z úst do úst. Samozřejmě je třeba vzít v úvahu, že pro osobu, která poskytuje pomoc, může být nebezpečné, když je vdechovaný materiál toxický, infekční nebo žíravý.
Při požití nevyvolávejte zvracení, uvolňujte oděv a pokud oběť nedýchá, proveďte resuscitaci z úst do úst.
Ve všech případech je třeba vyhledat okamžitou lékařskou pomoc (Bezpečnostní list materiálu Kyselina jodová, 2013).
Použití a přínosy pro zdraví
Kyselina jodová se běžně používá jako standardizační činidlo pro roztoky slabých a silných zásad. Je to silná kyselina, která se používá v analytické chemii k provádění titrací.
Používá se s indikátory metylové červeně nebo methyloranžové k provádění odečítání bodů ekvivalence v titracích.
Používá se v solném průmyslu k syntéze sodné nebo draselné jodičnanové soli. Použitím této sloučeniny kyseliny jodové při přípravě soli se zvyšuje obsah jódu v soli (Omkar Chemicals, 2016).
Tato sloučenina se již dlouho používá pro organickou syntézu, protože má schopnost selektivně oxidovat organické sloučeniny, vzhledem k jejímu působení provádět ekvivalentní parciální oxidační analýzu, což je užitečná technika pro stanovení struktur (Roger J. Williams, 1937).
Jód a kyselina jodová se používají jako účinná kombinace činidel pro jodaci arylhydroxyketonů. V práci (Bhagwan R. Patila, 2005) byly různé orto-hydroxy substituované aromatické karbonylové sloučeniny regioselektivně jodovány jodem a kyselinou jodovou s vynikajícími výtěžky..
Reference
- Bhagwan R. Patila, S. R. (2005). Jód a kyselina jodová: účinná kombinace činidel pro jodaci arylhydroxyketonů. Tetrahedron Letters Volume 46, Issue 42, 7179-7181. arkat-usa.org.
- KYSELINA JODIČNÁ. (S.F.). Obnoveno z chemicalland21: chemicalland21.com.
- Bezpečnostní list materiálu Kyselina jodičná. (2013, 21. května). Citováno z sciencelab: sciencelab.com.
- Národní centrum pro biotechnologické informace. (S.F.). Složená databáze PubChem; CID = 24345. Citováno z PubChem.
- Omkar Chemicals. (2016, 11. června). CHARAKTER JODIČSKÉ KYSELINY A JEJICH POUŽITÍ V RŮZNÝCH ÚČELECH. Obnoveno z oficiálního blogu Omkar Chemicals: omkarchemicals.com.
- Roger J. Williams, M. A. (1937). SELEKTIVITA KYSELINY JODIČNÉ V OXIDACI ORGANICKÝCH SLOUČENIN. Journal of American Chemical Society 59 (7), 1408-1409.
- Royal Society of Chemistry. (2015). Kyselina jodová. Citováno z chemspider: chemspider.com.

Zatím žádné komentáře