
Silné a slabé kyseliny a zásady

Klasifikace kyselin a zásad v chemii závisí na ionizační síle těchto látek ve vodném prostředí. A) Ano:
- A kyselina a báze jsou silné když jsou zcela ionizovány, tj. v ionizačním procesu jsou zcela transformovány na kationty nebo kladné ionty a na anionty nebo záporné ionty.
- Na druhou stranu, kyselina a báze jsou slabé když jsou částečně ionizovány ve vodě, to znamená, že v roztoku bude podíl kationtů, další podíl aniontů a další podíl nedisociovaných molekul.
| Silné kyseliny a zásady | Slabé kyseliny a zásady | |
|---|---|---|
| Definice | Látky, které zcela ionizují v roztoku. | Látky, které částečně ionizují v roztoku. |
| Ionizace | Kompletní | Částečný |
| Prvky ve vodném roztoku | Kationty a anionty ve stejné koncentraci. | Kationty, anionty a molekuly v různých poměrech. |
| Ionizační konstanta | Zvýšené | Málo |
| Příklady |
|
|
Silné kyseliny a zásady
A kyselina nebo báze jsou silné, jsou-li ve vodném prostředí úplně disociovány, to znamená, že ionizační proces je dokončen a roztok bude mít stejnou koncentraci aniontů jako kationty.
Jak ionizujete kyselinu a silnou bázi??
Silná kyselina, jako je kyselina chlorovodíková HCl, ionizuje následujícími způsoby:
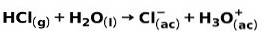
Silná báze, jako je hydroxid sodný NaOH, ionizuje následujícími způsoby:
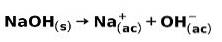
Příklady silných kyselin a jejich vzorce
| Silné kyseliny | Vzorec |
|---|---|
| Kyselina chlorovodíková | HCl |
| Kyselina sírová | HdvaSW4 |
| Kyselina dusičná | HNO3 |
| Kyselina bromovodíková | HBr |
| Kyselina chloristá | HClO4 |
| Kyselina chromová | HdvaCrO4 |
| Kyselina tetrafluroboritá | HBF4 |
Příklady silných zásad a jejich vzorců
| Silná základna | Vzorec |
|---|---|
| Hydroxid sodný | NaOH |
| Hydroxid lithný | LiOH |
| Hydroxid draselný | KOH |
| Hydroxid rubidnatý | RbOH |
| Hydroxid cesný | CsOH |
| Hydroxid vápenatý | Ca (OH)dva |
| Hydroxid barnatý | Ba (OH)dva |
| Hydroxid strontnatý | Sr (OH)dva |
| Hydroxid hlinitý | Al (OH)3 |
Mohlo by vás zajímat více příkladů kyselin a zásad.
Slabé kyseliny a zásady
A Kyselina nebo báze jsou slabé, pokud jsou částečně ionizovány ve vodném roztoku, to znamená, že v roztoku jsou ionty a neionizované molekuly.
Jak ionizujete kyselinu a slabou bázi??
Slabá kyselina, jako je kyselina octová CH3COOH, je ionizován následujícím způsobem:
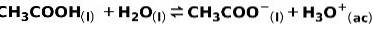
Rovnováha této reakce je vyjádřena dvěma šipkami v opačných směrech.
Když se slabá kyselina disociuje nebo ionizuje, nastává rovnováha mezi druhy přítomnými v roztoku; to může být vyjádřeno a ionizační konstanta kyselý:
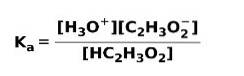
Ionizační konstanta není nic jiného než poměr mezi násobením koncentrace produktů a násobením koncentrace reaktantů.
Slabá báze, jako je NH amoniak3, ionizuje následujícím způsobem:
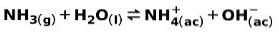
Když se slabá báze disociuje nebo ionizuje, nastává rovnováha mezi druhy přítomnými v roztoku; to může být vyjádřeno a základní ionizační konstanta:
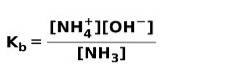
Mohlo by vás zajímat, jaké jsou rozdíly mezi kyselinami a zásadami.
Příklady slabých kyselin s jejich vzorcem a kyselou ionizační konstantou Kna
| Slabá kyselina | Vzorec | Ionizační konstanta |
|---|---|---|
| Kyselina mravenčí | HdvaCOdva | 1,77 x 10-4 |
| Octová kyselina | H3CCOH | 1,75 x 10-5 |
| Kyselina kyanovodíková | HOCN | 3,30 x 10-4 |
| Kyanovodík | HCN | 6,20 x 10-10 |
| Kyselina chlorná | HOCl | 3,50 x 10-8 |
| Kyselina dusitá | HNOdva | 4,00 x 10-4 |
| Kyselina mléčná | HC3H5NEBO3 | 1,40 x 10-4 |
| Kyselina uhličitá | HdvaCO3 | 4,30 x 10-7 5,60 x 10-jedenáct |
| Kyselina boritá | H3BO3 | 5,80 x 10-10 1,80 x 10-13 3,00 x 10-14 |
Příklady slabých bází s jejich vzorcem a základní ionizační konstantou Kb
| Slabá základna | Vzorec | Ionizační konstanta |
|---|---|---|
| Amoniak | NH3 | 1,75 x 10-5 |
| Methylamin | CH3NHdva | 4,38 x 10-4 |
| Ethylamin | CdvaH5NHdva | 5,60 x 10-4 |
| Anilin | C6H5NHdva | 3,80 x 10-10 |
| Pyridin | C5H5N | 1,70 x 10-9 |
| Benzylamin | C7H9N | 2,20 x 10-5 |
| Hydrogenuhličitan sodný | NaHCO | 2,00 x 10-4 |
Mohlo by vás zajímat více o charakteristikách kyselin a zásad


Zatím žádné komentáře