
Vlastnosti esterů, struktura, použití, příklady
The estery Jsou to organické sloučeniny, které mají složku karboxylové kyseliny a složku alkoholu. Jeho obecný chemický vzorec je RCOdvaR'' nebo RCOOR''. Pravá strana, RCOO, odpovídá karboxylové skupině, zatímco pravá strana, OR'' je to alkohol. Ti dva sdílejí atom kyslíku a sdílejí určitou podobnost s ethery (ROR ').
Z tohoto důvodu ethylacetát, CH3COOCHdvaCH3, nejjednodušší z esterů, byl považován za kyselina octová nebo octový ether, a tudíž i etymologický původ názvu „ester“. Ester tedy spočívá v substituci kyselého vodíku skupiny COOH alkylovou skupinou z alkoholu.

Kde se nacházejí estery? Od půd po organickou chemii je jejích přírodních zdrojů mnoho. Příjemná vůně ovoce, jako jsou banány, hrušky a jablka, je výsledkem interakce esterů s mnoha dalšími složkami. Vyskytují se také ve formě triglyceridů v olejích nebo tucích.
Naše tělo vyrábí triglyceridy z mastných kyselin, které mají dlouhé uhlíkové řetězce, a glycerol alkohol. To, co odlišuje některé estery od ostatních, spočívá jak v R, řetězci kyselé složky, tak v R ', v řetězci alkoholové složky..
Ester s nízkou molekulovou hmotností musí mít málo uhlíku v R a R ', zatímco jiné, jako jsou vosky, mají mnoho uhlíků, zejména v R', alkoholové složce, a proto vysoké molekulové hmotnosti..
Ne všechny estery jsou však přísně organické. Pokud je atom uhlíku karbonylové skupiny nahrazen jedním z fosforu, pak budeme mít RPOOR '. Toto se nazývá fosfátový ester a má zásadní význam ve struktuře DNA..
Dokud se tedy atom může účinně vázat na uhlík nebo kyslík, jako je síra (RSOOR '), může následně tvořit anorganický ester.
Rejstřík článků
- 1 Vlastnosti
- 1.1 Rozpustnost ve vodě
- 1.2 Hydrolýzní reakce
- 1.3 Redukční reakce
- 1.4 Transesterifikační reakce
- 2 Struktura
- 2.1 Akceptor vodíkové vazby
- 3 Názvosloví
- 4 Jak se tvoří?
- 4.1 Esterifikace
- 4.2 Estery z acylchloridů
- 5 použití
- 6 příkladů
- 7 Reference
Vlastnosti
Estery nejsou ani kyseliny, ani alkoholy, takže se tak nechovají. Například jejich teploty tání a varu jsou nižší než u těch s podobnou molekulovou hmotností, ale hodnotami se blíží hodnotám aldehydů a ketonů..
Kyselina butanová, CH3CHdvaCHdvaCOOH, má teplotu varu 164 ° C, zatímco ethylacetát, CH3COOCHdvaCH3, 77,1 ° C.
Kromě nedávného příkladu jsou body varu 2-methylbutanu, CH3CH (CH3) CHdvaCH3, methylacetátu, CH3COOCH3, a 2-butanol, CH3,CH (OH) CHdvaCH3, jsou následující: 28, 57 a 99 ° C. Všechny tři sloučeniny mají molekulovou hmotnost 72 a 74 g / mol..
Estery s nízkou molekulovou hmotností bývají těkavé a mají příjemný zápach, a proto jim jejich obsah v ovoci dodává známé vůně. Na druhou stranu, pokud jsou jejich molekulové hmotnosti vysoké, jsou to bezbarvé krystalické pevné látky bez zápachu nebo v závislosti na jejich struktuře vykazují mastné vlastnosti..
Rozpustnost ve vodě
Karboxylové kyseliny a alkoholy jsou obvykle rozpustné ve vodě, pokud nemají ve svých molekulárních strukturách vysoký hydrofobní charakter. Totéž platí pro estery. Když jsou R nebo R 'krátké řetězce, může ester interagovat s molekulami vody prostřednictvím dipól-dipólových sil a londýnských sil..
Je to proto, že estery jsou akceptory vodíkových vazeb. Jak? Svými dvěma atomy kyslíku RCOOR '. Molekuly vody tvoří vodíkové vazby s kterýmkoli z těchto kyslíků. Ale když jsou řetězy R nebo R 'velmi dlouhé, odpuzují vodu v jejich prostředí a znemožňují rozpuštění..
Zřejmým příkladem toho je estery triglyceridů. Jeho postranní řetězce jsou dlouhé a vytvářejí oleje a tuky nerozpustné ve vodě, pokud nejsou v kontaktu s méně polárním rozpouštědlem, které je více podobné těmto řetězcům..
Hydrolýzní reakce
Estery mohou také reagovat s molekulami vody při tzv. Hydrolýzní reakci. Vyžadují však dostatečně kyselé nebo bazické médium, které podporuje mechanismus uvedené reakce:
RCOOR ' + HdvaNEBO <=> RCOAch + R'OH
(Kyselé médium)
Molekula vody se přidává do karbonylové skupiny, C = O. Kyselinová hydrolýza je shrnuta v substituci každé R 'alkoholové složky OH z vody. Všimněte si také, jak se ester „rozpadá“ na dvě složky: karboxylovou kyselinu, RCOOH a alkohol R'OH..
RCOOR ' + Ach- => RCONEBO- + R'OH
(Základní médium)
Pokud se hydrolýza provádí v zásaditém médiu, dochází k nevratné reakci známé jako zmýdelnění. Toto je široce používáno a je základním kamenem při výrobě řemeslných nebo průmyslových mýdel..
RCOO- je stabilní karboxylátový aniont, který se elektrostaticky spojuje s převládajícím kationtem v médiu.
Pokud je použitou bází NaOH, vzniká RCOONa sůl. Když je ester triglycerid, který má ze své podstaty tři R postranní řetězce, tvoří se tři soli mastných kyselin, RCOONa a alkohol glycerol.
Redukční reakce
Estery jsou vysoce oxidované sloučeniny. Co to znamená? To znamená, že má několik kovalentních vazeb s kyslíkem. Eliminací vazeb C-O nastává zlom, který končí oddělením kyselých a alkoholových složek; Kyselina se dále redukuje na méně oxidovanou formu na alkohol:
RCOOR '=> RCHdvaOH + R'OH
Toto je redukční reakce. Je zapotřebí silné redukční činidlo, jako je lithiumaluminiumhydrid, LiAlH4, a z kyselého prostředí, které podporuje migraci elektronů. Alkoholy jsou nejmenší formy, tj. Ty, které mají nejméně kovalentní vazby s kyslíkem (pouze jedna: C-OH).
Dva alkoholy, RCHdvaOH + R'OH, pocházejí ze dvou příslušných řetězců původního RCOOR 'esteru. Toto je metoda syntézy alkoholů s přidanou hodnotou z jejich esterů. Například pokud byste chtěli vyrobit alkohol z exotického zdroje esterů, byla by to pro tento účel dobrá cesta..
Transesterifikační reakce
Estery lze přeměnit na jiné, pokud reagují v kyselém nebo zásaditém prostředí s alkoholy:
RCOOR ' + R "OH <=> RCONEBO " + R'OH
Struktura
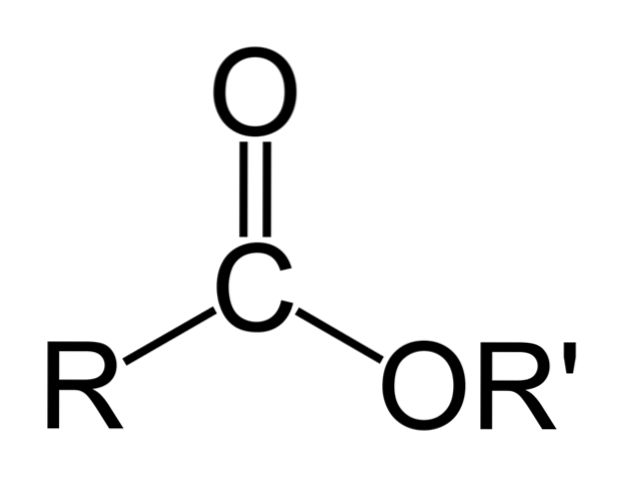
Horní obrázek představuje obecnou strukturu všech organických esterů. Všimněte si, že R, karbonylová skupina C = O a OR ', tvoří plochý trojúhelník, produkt sp hybridizacedva centrálního atomu uhlíku. Ostatní atomy však mohou přijmout jiné geometrie a jejich struktury závisí na vnitřní povaze R nebo R '.
Pokud R nebo R 'jsou jednoduché alkylové řetězce, například typu (CHdva)nCH3, ty se ve vesmíru objeví klikatě. To je případ pentylbutanoátu, CH3CHdvaCHdvaCOOCHdvaCHdvaCHdvaCHdvaCH3.
Ale v kterémkoli z uhlíků těchto řetězců lze nalézt rozvětvení nebo nenasycenost (C = C, C≡C), což by modifikovalo globální strukturu esteru. Z tohoto důvodu se jeho fyzikální vlastnosti, jako je rozpustnost a teplota varu a teploty tání, u každé sloučeniny liší..
Například nenasycené tuky mají ve svých R řetězcích dvojné vazby, které negativně ovlivňují mezimolekulární interakce. Výsledkem je, že jejich teploty tání klesají, dokud nejsou kapalné nebo oleje při pokojové teplotě..
Akceptor vodíkové vazby
Ačkoli trojúhelník kostry esteru vyniká více na obrázku, jsou to řetězce R a R ', které jsou zodpovědné za rozmanitost jejich struktur.
Trojúhelník si však zaslouží strukturní charakteristiku esterů: jsou akceptory vodíkové vazby. Jak? Prostřednictvím kyslíku karbonylových a alkoxidových skupin (-OR ').
Mají páry volných elektronů, které mohou přitahovat částečně kladně nabité atomy vodíku z molekul vody..
Jedná se tedy o speciální typ interakcí dipól-dipól. Molekuly vody se přibližují k esteru (pokud tomu nebrání řetězce R nebo R ') a tvoří se můstky C = O-HdvaO nebo OHdva-O-R '.
Nomenklatura
Jak jsou pojmenovány estery? Pro správné pojmenování esteru je třeba vzít v úvahu uhlíková čísla řetězců R a R '. Podobně jakékoli možné rozvětvení, substituent nebo nenasycení.
Jakmile je toto provedeno, ke jménu každého R 'alkoxidové skupiny -OR' je přidána přípona -yl, zatímco k řetězci R karboxylové skupiny -COOR přípona -ate. Nejprve je zmíněna sekce R, poté slovo „of“ a poté název sekce R “.
Například CH3CHdvaCHdvaCOOCHdvaCHdvaCHdvaCHdvaCH3 Má pět uhlíků na pravé straně, to znamená, že odpovídají R '. A na levé straně jsou čtyři atomy uhlíku (včetně karbonylové skupiny C = O). Proto R 'je pentylová skupina a R a butan (pro zahrnutí karbonylu a zvážení hlavního řetězce).
Chcete-li tedy sloučeninu pojmenovat, stačí přidat odpovídající přípony a pojmenovat je ve správném pořadí: butansvázaný pentilo.
Jak pojmenovat následující sloučeninu: CH3CHdvaCOOC (CH3)3? Řetězec -C (CH3)3 odpovídá terc-butyl alkylovému substituentu. Protože levá strana má tři uhlíky, je to „propan“. Jmenuje se tedy: propansvázaný terc-aleilo.
Jak se tvoří?
Esterifikace
Existuje mnoho způsobů syntézy esteru, z nichž některé mohou být dokonce nové. Všichni však konvergují k tomu, že musí být vytvořen trojúhelník v obraze struktury, tj. Vazba CO-O. Za tímto účelem musíte začít se sloučeninou, která dříve měla karbonylovou skupinu: jako je karboxylová kyselina.
A na co by se měla karboxylová kyselina vázat? K alkoholu by jinak neměl alkoholovou složku charakterizující estery. Karboxylové kyseliny však vyžadují teplo a kyselost, aby umožnily provedení reakčního mechanismu. Následující chemická rovnice představuje výše uvedené:
RCOOH + R'OH <=> RCOOR '+ HdvaNEBO
(Kyselé médium)
Toto je známé jako esterifikace.
Například mastné kyseliny mohou být esterifikovány methanolem, CH3OH, nahradit jeho kyselý H methylovými skupinami, takže tuto reakci lze také považovat za methylace. Toto je důležitý krok při určování profilu mastných kyselin určitých olejů nebo tuků..
Estery z acylchloridů
Další způsob syntézy esterů je z acylchloridů, RCOCl. V nich je místo substituce hydroxylové skupiny OH substituován atom Cl:
RCOCl + R'OH => RCOOR '+ HCl
A na rozdíl od esterifikace karboxylové kyseliny se neuvolňuje voda, ale kyselina chlorovodíková.
Ve světě organické chemie jsou k dispozici další metody, jako je Baeyer-Villigerova oxidace, při které se používají peroxykyseliny (RCOOOH)..
Aplikace

Mezi hlavní použití esterů patří:
-Při výrobě svíček nebo svíček, jako je ten na obrázku výše. Pro tento účel se používají estery s velmi dlouhým postranním řetězcem..
-Jako konzervační látky pro léky nebo potraviny. Je to způsobeno působením parabenů, které nejsou ničím jiným než estery kyseliny para-hydroxybenzoové. Ačkoli zachovávají kvalitu produktu, existují studie, které zpochybňují jeho pozitivní účinek na tělo.
-Používají se k výrobě umělých vůní, které napodobují vůni a chuť mnoha druhů ovoce nebo květin. Estery jsou tedy přítomny v sladkostech, zmrzlinách, parfémech, kosmetice, mýdlech, šamponech a dalších komerčních produktech, které si zaslouží atraktivní vůně nebo příchutě..
-Estery mohou mít také pozitivní farmakologický účinek. Z tohoto důvodu se farmaceutický průmysl věnuje syntéze esterů odvozených od kyselin přítomných v těle, aby vyhodnotil jakékoli možné zlepšení v léčbě nemocí. Aspirin je jedním z nejjednodušších příkladů těchto esterů.
-Kapalné estery, jako je ethylacetát, jsou vhodnými rozpouštědly pro určité typy polymerů, jako je nitrocelulóza a široká škála pryskyřic..
Příklady
Některé další příklady esterů jsou následující:
-Pentyl butanoát, CH3CHdvaCHdvaCOOCHdvaCHdvaCHdvaCHdvaCH3, který voní meruňkou a hruškami.
-Vinylacetát, CH3COOCHdva= CHdva, ze kterého se vyrábí polymer polyvinylacetátu.
-Isopentyl pentanoát, CH3CHdvaCHdvaCHdvaCOOCHdvaCHdvaCH (CH3)dva, který napodobuje chuť jablek.
-Ethylpropanoát, CH3CHdvaCOOCHdvaCH3.
-Propyl methanoát, HCOOCHdvaCHdvaCH3.
Reference
- T.W. Graham Solomons, Craigh B. Fryhle. Organická chemie. (Desáté vydání, str. 797-802, 820) Wiley Plus.
- Carey, F. A. Organic Chemistry (2006), šesté vydání. Nakladatelství Mc Graw Hill-
- Chemistry LibreTexts. Nomenklatura esterů. Obnoveno z: chem.libretexts.org
- Správce (2015, 19. září). Estery: jeho chemická podstata, vlastnosti a použití. Převzato z: pure-chemical.com
- Organická chemie v našem každodenním životě. (9. března 2014). Jaká jsou použití esterů? Obnoveno z: gen2chemistassignment.weebly.com
- Quimicas.net (2018). Příklady esterů. Obnoveno z: quimicas.net
- Paz María de Lourdes Cornejo Arteaga. Hlavní aplikace esterů. Převzato z: uaeh.edu.mx
- Jim Clark. (Leden 2016). Představujeme Estery. Převzato z: chemguide.co.uk

Zatím žádné komentáře