
Vlastnosti kvartérních sloučenin, tvorba, příklady
The kvartérní sloučeniny Jsou to všichni ti, kteří mají čtyři různé atomy nebo ionty. Mohou tedy být molekulárními nebo iontovými druhy. Mezi jejich rozmanitosti patří jak organická, tak anorganická chemie, což je velmi objemná skupina; i když možná ne tolik ve srovnání s binárními nebo ternárními sloučeninami.
Důvod, proč je jejich počet menší, je ten, že čtyři atomy nebo ionty musí být drženy pohromadě svou chemickou afinitou. Ne všechny prvky jsou navzájem kompatibilní a ještě méně, když se uvažuje o kvartetu; najednou se pár podobá více sobě než druhému páru.
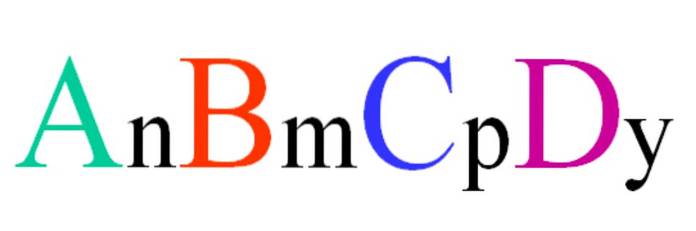
Zvažte kvartérní sloučeninu náhodného vzorce ABCD. Dolní indexy n, m, p a y jsou stechiometrické koeficienty, které zase udávají, jaký podíl každého atomu existuje ve vztahu k ostatním..
Tedy vzorec AnBmCpDY bude platit, pokud bude v souladu s elektronickou neutralitou. Dále bude taková sloučenina možná, pokud budou její čtyři atomy navzájem dostatečně příbuzné. Je zřejmé, že tento vzorec neplatí pro mnoho sloučenin, ale zejména pro slitiny nebo minerály..
Rejstřík článků
- 1 Charakteristika kvartérních sloučenin
- 1.1 Chemie
- 1.2 Fyzické
- 2 Názvosloví
- 2.1 Kyselé oxisales
- 2.2 Základní oxisales
- 2.3 Podvojné soli
- 2.4 Hydratované soli
- 3 Školení
- 4 příklady
- 5 Reference
Charakteristika kvartérních sloučenin
Chemikálie
Kvartérní sloučenina může být iontová nebo kovalentní a vykazuje vlastnosti očekávané pro svou povahu. Očekává se, že iontové sloučeniny ABCD budou rozpustné ve vodě, alkoholech nebo jiných polárních rozpouštědlech; měly by mít vysoké teploty varu a tání a při tavení být dobrými vodiči elektřiny.
Pokud jde o kovalentní sloučeniny ABCD, většina se skládá z dusíkatých, okysličených nebo halogenovaných organických sloučenin; to znamená, že jeho vzorec by se stal C.nHmNEBOpNY nebo C.nHmNEBOpXY, kde X je atom halogenu. Z těchto molekul by bylo logické myslet si, že jsou polární, vzhledem k vysokým elektronegativitám O, N a X.
Čistě kovalentní sloučenina ABCD může mít mnoho vazebných možností: A-B, B-C, D-A atd., Samozřejmě v závislosti na afinitách a elektronických kapacitách atomů. Zatímco v čistě iontové sloučenině ABCD jsou její interakce elektrostatické: A+B-C+D-, například.
V případě slitiny, považované spíše za pevnou směs než za sloučeninu, ABCD se skládá z neutrálních atomů v základních stavech (teoreticky).
Ze zbytku může být ABCD sloučenina neutrální, kyselá nebo bazická, v závislosti na identitě jejích atomů..
Fyzický
Fyzicky vzato je pravděpodobné, že ABCD se nestane plynem, protože čtyři různé atomy vždy znamenají vyšší molekulovou hmotnost nebo vzorec. Pokud se nejedná o kapalinu s vysokou teplotou varu, lze očekávat, že jde o pevnou látku, jejíž rozklad musí vytvářet mnoho produktů.
Jejich barvy, vůně, struktura, krystaly atd. Budou opět záviset na tom, jak ve sloučenině koexistují A, B, C a D, a budou záviset na jejich synergii a strukturách..
Nomenklatura
K otázce kvartérních sloučenin bylo dosud přistupováno globálně a nepřesně. Když vynecháme organickou chemii (amidy, benzylchloridy, kvartérní amonné soli atd.), V anorganické chemii existují dobře definované příklady nazývané kyselé a zásadité oxysoli..
Kyselý oxisales
Kyselé oxysoly jsou ty, které pocházejí z částečné neutralizace polyprotické oxokyseliny. Jeden nebo více jeho vodíků je tedy nahrazeno kovovými kationty a čím méně zbývajících vodíků bude mít, tím méně bude kyselý..
Například z kyseliny fosforečné H3PO4, Lze získat až dvě kyselé soli, například sodíku. Jsou to: NaHdvaPO4 (Na+ nahrazuje vodík ekvivalentní H+) a NadvaHPO4.
Podle tradiční nomenklatury jsou tyto soli pojmenovány stejným způsobem jako oxysolty (zcela deprotonované), ale se jménem „kov“ předchází název kovu. Tedy NaHdvaPO4 by byl fosforečnan sodný a NadvaHPO4 fosforečnan sodný (protože mu zbývá jeden H).
Naopak nomenklatura akcií upřednostňuje použití slova „vodík“ před „kyselinou“. NaHdvaPO4 by se pak stal dihydrogenfosforečnanem sodným a NadvaHPO4 hydrogenfosforečnan sodný. Tyto soli mají čtyři atomy: Na, H, P a O.
Základní oxisales
Základní oxysolty jsou ty, které ve svém složení obsahují OH anion-. Zvažte například sůl CaNO3OH (Cadva+ NE3- Ach-). Abychom to pojmenovali, stačilo by před název kovu uvést slovo „základní“. Jeho název by tedy byl: zásaditý dusičnan vápenatý. A co CuIO3ACH? Jmenoval by se: jodičnan měďnatý (Cudva+ IO3- Ach-).
Podle akciové nomenklatury se slovo „základní“ nahrazuje hydroxidem, za nímž následuje pomlčka před názvem oxoanionu.
Opakováním předchozích příkladů by jejich názvy byly pro každý z nich: hydroxid-dusičnan vápenatý a hydroxid-jodičnan měďnatý; nezapomeňte, že valence kovu musí být uvedena v závorkách a římskými číslicemi.
Podvojné soli
Ve dvojných solích existují dva různé kationy, které interagují se stejným typem aniontu. Předpokládejme dvojitou sůl: Cu3Faith (PO4)3 (Cudva+ Víra3+ PO43-). Jedná se o fosfát železa a mědi, ale nejvhodnější název, který se k tomu vztahuje, je: trojitý fosfát mědi (II) a železa (III).
Hydratované soli
Jedná se o hydráty a jediný rozdíl je v tom, že počet vody, která se má formulovat, je uveden na konci jejich jmen. Například MnCldva je chlorid manganatý.
Jeho hydrát, MnCldva4HdvaNebo se tomu říká tetrahydrát chloridu manganatého. Všimněte si, že existují čtyři různé atomy: Mn, Cl, H a O.
Slavná dvojitě hydratovaná sůl je Mohr's, Fe (NH4)dva(SW4)dva6HdvaO. Jmenuje se: dvojitý síran železnatý a hexahydrát amonný.
Výcvik
Opět se zaměřením na anorganické kvartérní sloučeniny se ukazuje, že jsou většinou produktem částečných neutralizací. Pokud k nim dojde v přítomnosti několika oxidů kovů, je pravděpodobné, že vzniknou podvojné soli; a pokud je médium velmi zásadité, vysráží se zásadité oxysolty.
A pokud mají molekuly vody na druhé straně afinitu ke kovu, budou se koordinovat přímo s ním nebo s ionty, které jej obklopují, za vzniku hydrátů.
Na straně slitiny musí být svařeny čtyři různé kovy nebo metaloidy, aby se vytvořily kondenzátory, polovodiče nebo tranzistory..
Příklady
Nakonec je uveden seznam s různými příklady kvartérních sloučenin. Čtenář jej může použít k otestování svých znalostí nomenklatury:
- PbCO3(ACH)dva
- Cr (HSO4)3
- NaHCO3
- ZnIOH
- Cudva(ACH)dvaSW3
- LidvaKAsO4
- KURS45HdvaNEBO
- AgAu (SO4)dva
- Případ42HdvaNEBO
- FeCl36HdvaNEBO
Reference
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Whitten, Davis, Peck a Stanley. (2008). Chemie. (8. vydání). Učení CENGAGE.
- Nomenklatura a anorganická formulace. [PDF]. Obnoveno z: recursostic.educacion.es
- Erika Thalîa Dobře. (2019). Podvojné soli. Akademie. Obnoveno z: academia.edu
- Wikipedia. (2019). Kvartérní amonný kation. Obnoveno z: en.wikipedia.org



Zatím žádné komentáře