
Struktura dimethylanilinu, vlastnosti, syntéza, použití

The dimethylanilin nebo dimethylfenylamin je organická sloučenina, která je tvořena benzenovým kruhem s aminoskupinou substituovanou dvěma methylovými skupinami. Jeho chemický vzorec je C.8HjedenáctN.
Je také známý jako N, N-dimethylanilin, protože se jedná o derivát anilinu, ve kterém jsou vodíky aminoskupiny nahrazeny dvěma methylovými skupinami. To z něj dělá terciární amin.
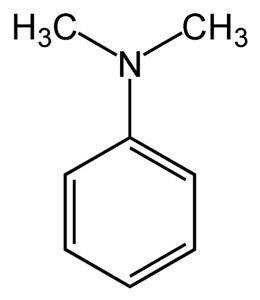
N, N-dimethylanilin je světle žlutá až hnědá olejovitá kapalina s charakteristickým zápachem aminů. Je to bazická sloučenina a reaguje s kyselinou dusitou za vzniku nitrososloučeniny. Při vystavení vzduchu zhnědne.
Používá se při výrobě barviv na barvy. Používá se také jako aktivátor polymeračních katalyzátorů a ve směsích používaných pro záznam obrazu. Na druhé straně se používá při syntéze antibakteriálních nebo antibiotických sloučenin, jako jsou některé cefalosporiny odvozené od penicilinu. N, N-dimethylanilin je také základem pro získání dalších chemických sloučenin.
Je to hořlavá kapalina a při zahřátí na rozklad vydává toxické výpary. Akutní expozice člověka N, N-dimethylanilinu může mimo jiné vést k negativním účinkům, jako jsou bolesti hlavy, závratě, snížení kyslíku v krvi a namodralé zbarvení kůže..
Rejstřík článků
- 1 Struktura
- 2 Názvosloví
- 3 Vlastnosti
- 3.1 Fyzický stav
- 3,2 Molekulová hmotnost
- 3.3 Teplota tání
- 3.4 Bod varu
- 3.5 Bod vzplanutí
- 3.6 Tlak páry
- 3.7 Teplota samovznícení
- 3.8 Hustota
- 3.9 Index lomu
- 3.10 Rozpustnost
- 3.11 Konstanta bazicity
- 3.12 Chemické vlastnosti
- 3.13 Rizika
- 4 Syntéza
- 5 použití
- 5.1 V průmyslu barviv
- 5.2 Při výrobě fototvrditelných směsí
- 5.3 Při výrobě skleněných vláken
- 5.4 Při syntéze antibiotik
- 5.5 Při katalýze chemických reakcí
- 5.6 V různých aplikacích
- 6 Reference
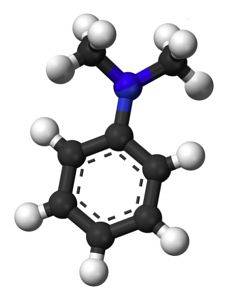
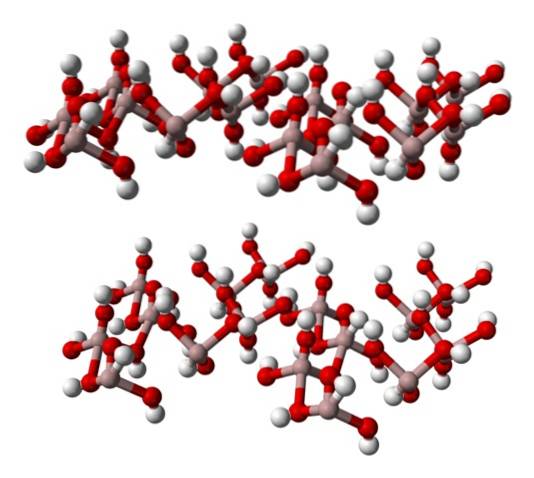
Struktura
Následující obrázek ukazuje prostorovou strukturu N, N-dimethylanilinu:
Nomenklatura
- N, N-dimethylanilin
- Dimethylanilin
- Dimethylfenylamin
- N, N-dimethylbenzenamin
N, N je umístěn v názvu, což znamená, že dvě methylové skupiny (-CH3) jsou připojeny k dusíku (N), nikoli k benzenovému kruhu.
Vlastnosti
Fyzický stav
Bledě žlutá až hnědá kapalina.
Molekulární váha
121,18 g / mol.
Bod tání
3 ° C.
Bod varu
194 ° C.
Bod vzplanutí
63 ° C (metoda uzavřeného kelímku). Je to minimální teplota, při které vydává páry, které se mohou vznítit, pokud nad ní prochází plamen..
Tlak páry
0,70 mm Hg při 25 ° C.
teplota samovznícení
371 ° C Je to minimální teplota, při které spontánně hoří při atmosférickém tlaku bez vnějšího zdroje tepla nebo plamene..
Hustota
0,9537 g / cm3 při 20 ° C.
Index lomu
1,5582 při 20 ° C.
Rozpustnost
Ve vodě je velmi málo rozpustný: 1 454 mg / l při 25 ° C.
Je snadno rozpustný v alkoholu, chloroformu a etheru. Rozpustný v acetonu, benzenu a okysličených a chlorovaných rozpouštědlech.
Konstanta bazicity
K.b 11.7, což naznačuje, s jakou lehkostí tato sloučenina přijímá vodíkový iont z vody.
Chemické vlastnosti
N, N-dimethylanilin je bazická sloučenina. Reakcí s kyselinou octovou se získá N, N-dimethylaniliniumacetát.
Skupina -N (CH3)dva N, N-dimethylanilinu je silný aktivátor aromatické substituce v dané poloze v následujících situacích benzenového kruhu.
Reaguje s dusitanem sodným (NaNOdva) v přítomnosti kyseliny chlorovodíkové (HCl) za vzniku p-nitroso-N, N-dimethylanilinu. Také s kyselinou dusitou vytváří na místě stejnou nitrosovanou sloučeninu v následujících situacích.
Když N, N-dimethylanilin reaguje s benzendiazoniumchloridem, v mírně kyselém prostředí se vytvoří azosloučenina typu Ar-N = N-Ar ', kde Ar je aromatická skupina. Molekuly s azoskupinami jsou silně zbarvené sloučeniny.
Rizika
Při zahřátí na rozklad vydává vysoce toxické páry anilinu a oxidy dusíku NOX.
Je to hořlavá kapalina.
Ve vodě vystavené slunečnímu záření se pomalu rozkládá. Neodbourává se.
Těká z mokré půdy a vodních ploch. Neodpařuje se ze suché půdy a pohybuje se skrz ni. Neakumuluje se v rybách.
Může být absorbován kůží. Rovněž se rychle vstřebává při vdechování. Vystavení člověka N, N-dimethylanilinu může snížit obsah kyslíku v krvi, což má za následek modravé zabarvení kůže..
Akutní vdechování této sloučeniny může vést k negativním účinkům na centrální nervový systém a oběhový systém s bolestmi hlavy, cyanózou a závratěmi..
Syntéza
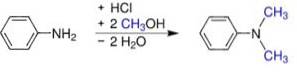
Lze jej vyrobit několika způsoby:
- Z anilinu a methanolu pod tlakem v přítomnosti kyselých katalyzátorů, jako je HdvaSW4. Získá se síran, který se převede na bázi přidáním hydroxidu sodného.
- Průchod anilinové páry a dimethyletheru přes aktivovaný oxid hlinitý.
- Zahřívání směsi anilinu, aniliniumchloridu a methanolu pod tlakem a následná destilace.
Aplikace
V průmyslu barviv
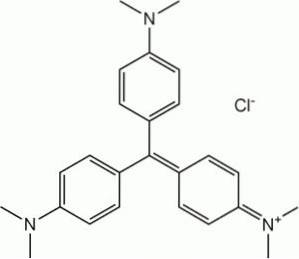
Kvůli vlastnosti reagovat s benzendiazoniumchloridem za vzniku azosloučenin se N, N-dimethylanilin používá jako meziprodukt při výrobě barviv..
Je to surovina při syntéze barviv z rodiny methylových fialek.
Při výrobě směsí, které lze vytvrdit
N, N-dimethylanilin je součástí fototvrditelné směsi, která prochází vytvrzovací reakcí v důsledku vysoké citlivosti na viditelné nebo blízké infračervené světlo, takže ji lze použít pro záznam obrazu nebo fotorezistní materiály..
N, N-dimethylanilin je jednou ze složek směsi, která způsobuje senzibilizaci na vlnové délky, a to takovým způsobem, že je kompozice vytvrzována světlem nízkoenergetických vlnových délek.
Odhaduje se, že role N, N-dimethylanilinu pravděpodobně potlačuje terminační reakci radikální polymerace způsobenou kyslíkem..
Ve výrobě ze skleněných vláken
N, N-dimethylanilin se používá jako katalytické tvrdidlo v některých pryskyřicích ze skleněných vláken.
Při syntéze antibiotik
N, N-dimethylanilin se podílí na syntéze cefalosporinů vycházející z penicilinů.
Penicilinsulfoxidy se převádějí na cefémové deriváty zahříváním v přítomnosti bazických katalyzátorů, jako je N, N-dimethylanilin.
Tyto cefalosporiny vykazují antibakteriální aktivitu proti grampozitivním a gramnegativním organismům, jakož i proti penicilin-rezistentním stafylokokům..
Je však třeba poznamenat, že N, N-dimethylanilin zůstává v těchto antibiotikách jako nečistota..
Při katalýze chemických reakcí
N, N-dimethylanilin se používá při aktivaci katalyzátorů polymerace olefinů.
Používá se společně s pentafluorfenolem (C.6F5OH), se kterým tvoří iontovou sloučeninu [HNPhMedva]+[H (OC6F5)dva]-. Tato iontová sloučenina má jeden nebo dva aktivní protony, které aktivují katalyzátor na bázi přechodného kovu.
Kromě toho se při výrobě pryskyřic používá N, N-dimethylanilin jako urychlovač polymerace nebo promotor pro tvorbu polyesterových pryskyřic. Jeho působení generuje rychlé vytvrzení pryskyřice.
V různých aplikacích
Používá se při syntéze dalších chemických sloučenin, například vanilinu, a jako meziprodukt pro farmaceutické léky.
Používá se také jako rozpouštědlo, jako alkylační činidlo, jako stabilizátor a pro výrobu barev a nátěrů..
Reference
- S. National Library of Medicine. (2019). N, N-dimethylanilin. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Morrison, R.T. a Boyd, R.N. (2002). Organická chemie. 6. vydání. Prentice-Hall.
- (2000). N, N-dimethylanilin. Souhrn. Obnoveno z epa.gov
- Zanaboni, P. (1966). Nenasycená polyesterová pryskyřičná kompozice, která má vysokou stabilitu a rychlé vytvrzování při nízkých teplotách za použití směsi dimethylanilinu, triethanolaminu a difenylaminu. NÁS. Patent č. 3 236 915. 22. února 1966.
- Nudelman, A. a McCaully, R.J. (1977). Způsob přesmyku penicilinů na cefalosporiny a jejich meziprodukty. NÁS. Patent č. 4 010 156. 1. března 1977.
- Kouji Inaishi (2001). Foto vytvrditelná kompozice. NÁS. Patent č. 6 171 759 B1. 9. ledna 2001.
- Luo, L. a kol. (2012). Iontová kyselina bronstedová. NÁS. Patent č. 8 088 952 B2. 3. ledna 2012.


Zatím žádné komentáře