
Struktura dimethylaminu ((CH3) 2NH), vlastnosti, použití, rizika

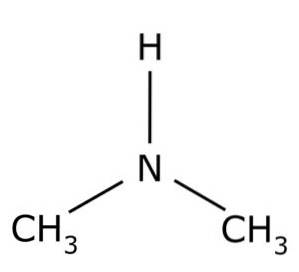
The dimethylamin je organická sloučenina tvořená dvěma methylovými skupinami -CH3 připojený ke skupině -NH. Jeho chemický vzorec je (CH3)dvaNH. Je to bezbarvý plyn. Když je ve vzduchu při nízkých koncentracích, je vnímán rybí zápach. Pokud je však ve vysoké koncentraci, má zápach amoniaku NH3.
Dimethylamin je přítomen v rostlinách a zvířatech. Předpokládá se, že u lidí pochází z rozpadu určitých enzymů, ale také z požití některých potravin, jako jsou ryby. Pokud se plynný dimethylamin rozpouští ve vodě, vytváří vysoce alkalické a korozivní roztoky.
Má různá průmyslová využití, například k výrobě rozpouštědel, k urychlení vulkanizace kaučuku, k potlačení koroze trubek, k výrobě mýdel, k přípravě barviv a k absorpci kyselých plynů v určitých procesech..
Dimethylamin je vysoce hořlavý plyn. Nádoby by neměly být vystaveny teplu nebo ohni, protože by mohly explodovat. Kromě toho jeho páry dráždí oči, kůži a dýchací cesty..
Je to sloučenina, která může být součástí atmosférických aerosolů, tj. Velmi jemných kapiček v atmosféře.
Rejstřík článků
- 1 Struktura
- 2 Názvosloví
- 3 Vlastnosti
- 3.1 Fyzický stav
- 3,2 Molekulová hmotnost
- 3.3 Teplota tání
- 3.4 Bod varu
- 3.5 Bod vzplanutí
- 3.6 Teplota samovznícení
- 3.7 Hustota
- 3.8 Rozpustnost
- 3,9 pH
- 3.10 Disociační konstanta
- 3.11 Chemické vlastnosti
- 3.12 Další vlastnosti
- 3.13 Biochemické reakce
- 4 Získání
- 5 Přítomnost v přírodě
- 5.1 Pacienti s nadbytkem dimethylaminu
- 6 použití
- 7 Rizika
- 8 Vliv DMA na atmosféru
- 9 Odkazy
Struktura
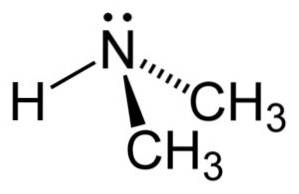
Dimethylamin je sekundární alifatický amin. To znamená, že dusíkové substituenty (N) jsou alifatické (-CH)3), což znamená, že nejsou aromatické a že jsou dva. Proto jsou to dva methyly -CH3 připojený k dusíku, který má také vodík (H).
V molekule dimethylaminu má dusík (N) pár volných elektronů, tj. Pár elektronů, které nejsou vázány na žádný jiný atom..
Nomenklatura
- Dimethylamin
- N, N-dimethylamin
- N-methylmethanamin
- DMA (zkratka pro di-methyl-amin).
Vlastnosti
Fyzický stav
Bezbarvý plyn.
Molekulární váha
45,08 g / mol
Bod tání
-93 ° C
Bod varu
7,3 ° C
Bod vzplanutí
-6,69 ° C (metoda uzavřeného kelímku).
teplota samovznícení
400 ° C
Hustota
Kapalina = 0,6804 g / cm3 při 0 ° C.
Výpary = 1,6 (relativní hustota vzhledem ke vzduchu, vzduch = 1).
Rozpustnost
Velmi dobře rozpustný ve vodě: 163 g / 100 g vody při 40 ° C. Rozpustný v ethanolu a ethyletheru.
pH
Vodné roztoky dimethylaminu jsou silně zásadité.
Disociační konstanta
K.b = 5,4 x 10-4
pKna konjugovaná kyselina = 10 732 při 25 ° C Konjugovanou kyselinou je dimethylamoniový ion: (CH3) NHdva+
Chemické vlastnosti
Kapalný dimethylamin může napadnout některé plasty, gumy a povlaky.
Když je rozpuštěn ve vodě, volný dusíkový elektronový pár (N) přijímá proton (H+) z vody a ponechává OH volný-, takže tvoří velmi zásaditá a korozivní řešení:
Dimethylamin + Voda → Dimethylamonium Ion + Hydroxyl Ion
(CH3)dvaNH + HdvaO → (CH3)dvaNHdva+ + Ach-
S kyselinou dusičnou získáte dusičnanovou sůl, tj. Dimethylamonium dusičnan:
Dimethylamin + kyselina dusičná → Dimethylamonium dusičnan
(CH3)dvaNH + HNO3 → (CH3)dvaNHdva+NE3-
Další vlastnosti
Když je ve vzduchu v nízké koncentraci, má rybí zápach, zatímco ve vysokých koncentracích voní jako amoniak (NH3).
Biochemické reakce
V těle může dimethylamin procházet nitrosací za slabě kyselých podmínek za vzniku dimethylnitrosaminu karcinogenní sloučeniny (CH3)dvaN-NO.
K tvorbě dimethylnitrosaminu dochází z dimethylaminu a dusitanu (dusitanu sodného) v žaludku (při pH 5-6) působením bakterií v gastrointestinálním traktu. Dusitan sodný je přítomen v některých potravinách.
Dimethylamin + Dusitan sodný → Dimethylnitrosamin + Hydroxid sodný
(CH3)dvaNH + NaNOdva → (CH3)dvaN-NO + NaOH
Získávání
Dimethylamin se komerčně připravuje reakcí methanolu (CH3OH) s amoniakem (NH3) při 350-450 ° C v přítomnosti katalyzátoru na bázi oxidu křemičitého a oxidu hlinitého (SiOdva/ DodvaNEBO3).
2 CH3OH + NH3 → (CH3)dvaNH + 2 HdvaNEBO
Protože se také vyrábí monomethylamin a trimethylamin, provádí se čištění v řadě čtyř až pěti destilačních kolon..
Přítomnost v přírodě
Dimethylamin se nachází v rostlinách a zvířatech. Je také přirozeně a hojně přítomen v lidské moči.
Odhaduje se, že jeho přítomnost u lidí je způsobena skutečností, že je produkován určitými typy střevních bakterií z některých sloučenin nalezených v potravinách.
Některé z těchto sloučenin jsou cholin (sloučenina spojená se skupinou vitaminů B) a trimethylaminoxid. Předpokládá se také, že pochází z enzymu, který inhibuje oxid dusnatý (NO), který se tvoří v těle..
Některé zdroje informací naznačují, že nárůst dimethylaminu v moči je způsoben požitím ryb a mořských plodů, kde jsou nejvyšší hodnoty dosaženy při konzumaci chobotnice, štikozubce obecného, sardinek, mečounů, tresky, tresky bezvousé a paprsku..

Pacienti s nadbytkem dimethylaminu
Dimethylamin je považován za uremický toxin, tj. Látku, která může poškodit, pokud je jeho koncentrace v moči příliš vysoká. Ve skutečnosti byly u pacientů s terminálním stadiem onemocnění ledvin pozorovány velmi vysoké hladiny dimethylaminu..
Předpokládá se, že u těchto pacientů může dojít k přelidnění střevních bakterií, které by je mohly produkovat.
Aplikace
Dimethylamin nebo DMA se používá k:
- Příprava dalších sloučenin.
- Výroba rozpouštědel dimethylformamidu a dimethylacetamidu.
- Urychlete vulkanizaci určitých kaučuků.
- Během opalování odstraňte vlasy z kůže.
- Působí jako antioxidant pro rozpouštědla.
- Slouží jako minerální flotační prostředek.
- Inhibují korozi a jako prostředek proti znečištění potrubí.
- Funguje jako povrchově aktivní látka.
- Vyrábejte mýdla a čisticí prostředky.
- Působte jako chemička textilu.
- Funguje jako protiblokovací prostředek v palivech a jako stabilizátor benzinu.
- Připravte barviva.
- Absorbujte kyselé plyny.
- Slouží jako hnací plyn pro pesticidy a rakety.
- Buďte součástí prostředků na úpravu vody.
- Působí jako fungicid v agrochemických produktech.
- Ukončená použití, jako je přitahování a zabíjení nosatců nebo hmyzu, který napadá bavlnu.


Rizika
Páry dimethylaminu dráždí pokožku, oči a dýchací cesty..
Při kontaktu s pokožkou v kapalné formě může způsobit omrzliny a chemické popáleniny. Jeho vdechování má nepříznivé účinky na zdraví.
DMA plyn je korozivní a může vytvářet korozivní vodné roztoky. Vaše vodné roztoky se mohou stát hořlavými, pokud nejsou dobře naředěny..
Dimethylamin v plynné formě se snadno vznítí a vytváří toxické výpary oxidů dusíku (NOX).
Pokud je nádoba obsahující tento plyn vystavena ohni nebo silnému teplu, může explodovat..
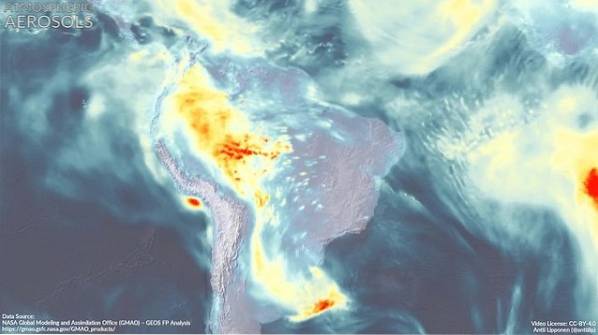
Vliv DMA na atmosféru
Atmosférický aerosol (velmi malé kapičky směsi přírodních sloučenin a / nebo znečišťujících látek v atmosféře) má zásadní dopad na globální klima a na kvalitu ovzduší v různých oblastech světa..
Tvorba nových aerosolových částic není dosud plně objasněna.
Odhaduje se, že dimethylamin se podílí spolu s dalšími sloučeninami na tvorbě těchto částic, což se zdá být závislé na skutečnosti, že v této oblasti existují silné emise DMA..
Například v průmyslových oblastech je vyšší koncentrace než v zemědělských oblastech, což může ovlivnit způsob, jakým se účastní rámcová směrnice o vodě..
Je pozoruhodné, že podle některých vědců může spalování rostlinného materiálu obsahujícího glyfosát (jeden z nejpoužívanějších herbicidů na světě) vést k tvorbě dimethylaminu.
Reference
- NÁS. Národní lékařská knihovna. (2019). Dimethylamin. Obnoveno z pubchem.ncbi.nlm.nih.gov.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Čtvrté vydání. John Wiley & Sons.
- Morrison, R.T. a Boyd, R.N. (2002). Organická chemie. 6. vydání. Prentice-Hall.
- Windholz, M. a kol. (redaktoři) (1983). Index společnosti Merck. Encyclopedia of Chemicals, Drugs, and Biologicals. Desáté vydání. Merck & CO., Inc..
- Abramowitz, M.K. et al. (2010). Patofyziologie uremie. Alifatické aminy. In Chronické onemocnění ledvin, dialýza a transplantace (třetí vydání). Obnoveno ze sciencedirect.com.
- Li, H. a kol. (2019). Vliv atmosférických podmínek na tvorbu nových částic na bázi kyseliny sírové, dimethylaminu a amoniaku. Chemosphere 2019; 245: 125554. Obnoveno z ncbi.nlm.nih.gov.
- Mackie, J.C. a Kennedy, E.M. (2019). Pyrolýza glyfosátu a jeho toxických produktů. Environ. Sci. Technol. 2019: 53 (23): 13742-13747. Obnoveno z ncbi.nlm.nih.gov.



Zatím žádné komentáře