
Vysvětlení Henderson-Hasselbalchovy rovnice, příklady, cvičení
The Henderson-Hasselbalchova rovnice je matematický výraz, který umožňuje výpočet pH pufru nebo pufrového roztoku. Je založen na pKa kyseliny a vztahu mezi koncentracemi konjugované báze nebo soli a kyseliny přítomné v pufrovacím roztoku..
Rovnici původně vytvořil Lawrence Joseph Henderson (1878-1942) v roce 1907. Tento chemik vytvořil komponenty své rovnice založené na kyselině uhličité jako pufr nebo pufr..
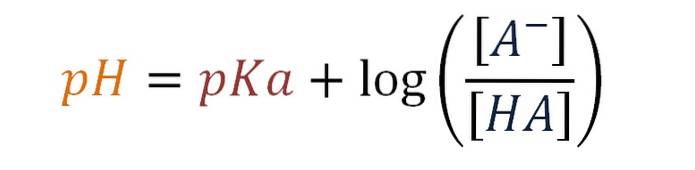
Později Karl Albert Hasselbalch (1874-1962) zavedl v roce 1917 použití logaritmů k doplnění Hendersonovy rovnice. Dánský chemik studoval reakce krve s kyslíkem a vliv na jeho pH.
Pufrovací roztok je schopen minimalizovat změny pH, kterým roztok prochází, přidáním objemu silné kyseliny nebo zásady. Je složen ze slabé kyseliny a její silné konjugované báze, která se rychle disociuje.
Rejstřík článků
- 1 Vysvětlení
- 1.1 Matematický vývoj
- 1.2 Rovnice pro slabý základ
- 2 Jak funguje vyrovnávací paměť?
- 2.1 Tlumící akce
- 2.2 Kapacita vyrovnávací paměti
- 3 Příklady Hendersonových rovnic
- 3.1 Acetátový tlumič nárazů
- 3.2 Pufr s kyselinou uhličitou
- 3.3 Laktátový pufr
- 3.4 Fosfátový pufr
- 3.5 Oxyhemoglobin
- 3.6 Deoxyhemoglobin
- 4 Vyřešená cvičení
- 4.1 Cvičení 1
- 4.2 Cvičení 2
- 4.3 Cvičení 3
- 5 Reference
Vysvětlení
Matematický vývoj
Slabá kyselina ve vodném roztoku se disociuje podle zákona hromadné akce podle následujícího schématu:
HA + Hdva⇌ H+ + NA-
HA je slabá kyselina a A- jeho konjugovaná báze.
Tato reakce je reverzibilní a má rovnovážnou konstantu (Ka):
Ka = [H+] · [TO-] / [HA]
Logaritmy:
log Ka = log [H+] + Protokol [A-] - přihlásit [HA]
Pokud je každý člen rovnice vynásoben (-1), je vyjádřen následovně:
- log Ka = - log [H+] - protokol [A] + protokol [HA]
- log Ka je definován jako pKa a - log [H+] je definováno jako pH. Po provedení správné substituce se matematický výraz sníží na:
pKa = pH - log [A-] + Protokol [HA]
Při řešení pojmů pH a přeskupení je rovnice vyjádřena takto:
pH = pKa + log [A-] / [HA]
Toto je Henderson-Hasselbalchova rovnice pro slabý kyselý pufr.
Rovnice pro slabou základnu
Podobně může slabá základna tvořit nárazník a Henderson-Hasselbalchova rovnice pro ni je následující:
pOH = pKb + log [HB] / [B-]
Většina pufrových roztoků však pochází, i když jsou fyziologicky důležité, z disociace slabé kyseliny. Proto nejpoužívanějším výrazem pro Henderson-Hasselbalchovu rovnici je:
pH = pKa + log [A-] / [HA]
Jak funguje vyrovnávací paměť?
Tlumící akce
Henderson-Hasselbalchova rovnice naznačuje, že tento roztok je tvořen slabou kyselinou a silnou konjugovanou bází vyjádřenou jako sůl. Tato kompozice umožňuje pufrovacímu roztoku zůstat na stabilním pH, i když jsou přidány silné kyseliny nebo zásady..
Když se do pufru přidá silná kyselina, reaguje s konjugovanou bází za vzniku soli a vody. To neutralizuje kyselinu a umožňuje minimální odchylku pH..
Nyní, pokud je do pufru přidána silná báze, reaguje se slabou kyselinou a vytváří vodu a sůl, čímž neutralizuje účinek přidané báze na pH. Variace pH je proto minimální.
PH pufrového roztoku závisí na poměru koncentrací konjugované báze a slabé kyseliny, nikoli na absolutní hodnotě koncentrací těchto složek. Pufrovací roztok může být naředěn vodou a pH bude prakticky nezměněno.
Kapacita vyrovnávací paměti
Pufrovací kapacita také závisí na pKa slabé kyseliny, jakož i na koncentracích slabé kyseliny a konjugované báze. Čím blíže je pH pufru k pKa kyseliny, tím větší je jeho pufrovací kapacita..
Podobně čím vyšší je koncentrace složek pufrovacího roztoku, tím větší je jeho pufrovací kapacita..
Příklady Hendersonových rovnic
Acetátový tlumič nárazů
pH = pKa + log [CH3VRKAT-] / [CH3COOH]
pKa = 4,75
Pufr s kyselinou uhličitou
pH = pKa + log [HCO3-] / [HdvaCO3]
pKa = 6.11
Celkový proces, který vede k tvorbě hydrogenuhličitanového iontu v živém organismu, je však následující:
COdva + HdvaO ⇌ HCO3- + H+
Být COdva plyn, jeho koncentrace v roztoku je vyjádřena jako funkce jeho parciálního tlaku.
pH = pka + log [HCO3-] / α pCOdva
a = 0,03 (mmol / l) / mmHg
pCOdva je parciální tlak COdva
A pak by rovnice vypadala takto:
pH = pKa + log [HCO3-] / 0,03 pCOdva
Laktátový pufr
pH = pKa + log [laktátový ion] / [kyselina mléčná]
pKa = 3,86
Fosfátový pufr
pH = pKa + log [dibázický fosfát] / [monobázický fosfát]
pH = pKa + log [HPO4dva-] / [HdvaPO4-]
pKa = 6,8
Oxyhemoglobin
pH = pKa + log [HbOdva-] / [HHbOdva]
pKa = 6,62
Deoxyhemoglobin
pH = pKa + log [Hb-] / HbH
pKa = 8,18
Vyřešená cvičení
Cvičení 1
Fosfátový pufr je důležitý při regulaci tělesného pH, protože jeho pKa (6,8) se blíží hodnotě pH v těle (7,4). Jaká bude hodnota vztahu [NadvaHPO4dva-] / [NaHdvaPO4-] Henderson-Hasselbalchovy rovnice pro hodnotu pH = 7,35 a pKa = 6,8?
Disociační reakce NaHdvaPO4- to je:
NaHdvaPO4- (kyselina) ⇌ NaHPO4dva- (základ) + H+
pH = pKa + log [NadvaHPO4dva-] / [NaHdvaPO4-]
Při řešení poměru [konjugovaná báze / kyselina] pro fosfátový pufr máme:
7,35 - 6,8 = log [NadvaHPO4dva-] / [NaHdvaPO4-]
0,535 = log [NadvaHPO4dva-] / [NaHdvaPO4-]
100,535 = 10log [Na2HPO4] / [NaH2PO4]
3,43 = [NadvaHPO4dva-] / [NaHdvaPO4-]
Cvičení 2
Acetátový pufr má koncentraci kyseliny octové 0,0135 M a koncentraci octanu sodného 0,0260 M. Vypočítejte pH pufru s vědomím, že pKa pro acetátový pufr je 4,75.
Disociační rovnováha pro kyselinu octovou je:
CH3COOH ⇌ CH3VRKAT- + H+
pH = pKa + log [CH3VRKAT-] / [CH3COOH]
Nahrazením hodnot, které máme:
[CH3VRKAT-] / [CH3COOH] = 0,0260 M / 0,0135 M
[CH3VRKAT-] / [CH3COOH] = 1,884
log 1,884 = 0,275
pH = 4,75 + 0,275
pH = 5,025
Cvičení 3
Acetátový pufr obsahuje 0,1 M kyselinu octovou a 0,1 M octan sodný. Po přidání 5 ml 0,05 M kyseliny chlorovodíkové k 10 ml výše uvedeného roztoku se vypočítá pH pufru.
Prvním krokem je výpočet konečné koncentrace HCl po smíchání s pufrovacím roztokem:
ViCi = VfCf
Cf = Vi · (Ci / Vf)
= 5 ml · (0,05 M / 15 ml)
= 0,017 M
Kyselina chlorovodíková reaguje s octanem sodným za vzniku kyseliny octové. Koncentrace octanu sodného proto klesá o 0,017 M a koncentrace kyseliny octové se zvyšuje o stejné množství:
pH = pKa + log (0,1 M - 0,017 M) / (0,1 M + 0,017 M)
pH = pKa + log 0,083 / 0,017
= 4,75 - 0,149
= 4,601
Reference
- Whitten, Davis, Peck a Stanley. (2008). Chemie. (8. vydání). Učení CENGAGE.
- Jimenez Vargas a J. Mª Macarulla. (1984). Fyziologická fyzikálně chemie. 6. vydání. Redakční Interamericana.
- Wikipedia. (2020). Henderson-Hasselbalchova rovnice. Obnoveno z: en.wikipedia.org
- Gurinder Khaira a Alexander Kot. (5. června 2019). Henderson-Hasselbalchova aproximace. Chemistry LibreTexts. Obnoveno z: chem.libretexts.org
- Helmenstine, Anne Marie, Ph.D. (29. ledna 2020). Definice Henderson Hasselbalchovy rovnice. Obnoveno z: thoughtco.com
- Redaktoři Encyclopaedia Britannica. (6. února 2020). Lawrence Joseph Henderson. Encyklopedie Britannica. Obnoveno z: britannica.com



Zatím žádné komentáře