
Vlastnosti sfingolipidů, funkce, skupiny, syntéza

The sfingolipidy představují jednu ze tří hlavních rodin lipidů přítomných v biologických membránách. Stejně jako glycerofosfolipidy a steroly jsou to amfipatické molekuly s hydrofilní polární oblastí a hydrofobní nepolární oblastí..
Poprvé je popsal v roce 1884 Johann L. W. Thudichum, který popsal tři sfingolipidy (sfingomyelin, cerebrosidy a cerebrosulfatid), které patří do tří různých známých tříd: fosfoesfingolipidy, neutrální a kyselé glykosfingolipidy..
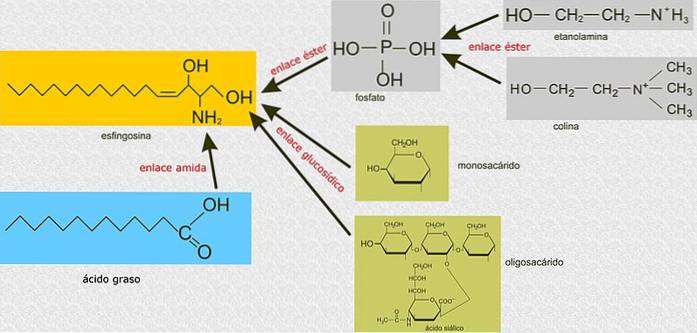
Na rozdíl od glycerofosfolipidů nejsou sfingolipidy postaveny na molekule glycerol 3-fosfátu jako hlavní kostře, ale jsou to sloučeniny odvozené od sfingosinu, aminoalkoholu s dlouhým uhlovodíkovým řetězcem spojeným amidovou vazbou..
Pokud jde o složitost a rozmanitost, je u sfingolipidů u savců známo alespoň 5 různých typů bází. Tyto báze mohou být spojeny s více než 20 různými typy mastných kyselin, s různou délkou a stupněm nasycení, navíc k několika variacím v polárních skupinách, které se mohou vyskytnout..
Biologické membrány mají asi 20% sfingolipidů. Ty mají různé a důležité funkce v buňkách, od strukturální po signální transdukci a řízení různých buněčných komunikačních procesů..
Distribuce těchto molekul se liší v závislosti na funkci organely, kde se nacházejí, ale obvykle je koncentrace sfingolipidů mnohem vyšší ve vnější monovrstvě plazmatické membrány ve srovnání s vnitřní monovrstvou a jinými kompartmenty..
U lidí existuje nejméně 60 druhů sfingolipidů. Mnohé z nich jsou důležitými složkami membrán nervových buněk, zatímco jiné hrají důležité strukturální role nebo se účastní mimo jiné signální transdukce, rozpoznávání, buněčné diferenciace, patogeneze, programované buněčné smrti..
Rejstřík článků
- 1 Struktura
- 2 Funkce
- 3 funkce
- 3.1 - Strukturální funkce
- 3.2 - Signální funkce
- 3,3 -As receptory v membráně
- 4 Skupiny sfingolipidů
- 4.1 Sfingomyeliny
- 4.2 Neutrální glykolipidy nebo glykosfingolipidy (bez poplatku)
- 4.3 Kyselé gangliosidy nebo glykosfingolipidy
- 5 Syntéza
- 5.1 Syntéza kostry ceramidu
- 5.2 Tvorba specifických sfingolipidů
- 6 Metabolismus
- 6.1 Nařízení
- 7 Reference
Astruktura
Všechny sfingolipidy jsou odvozeny od L-serinu, který je kondenzován s mastnou kyselinou s dlouhým řetězcem za vzniku sfingoidové báze, známé také jako báze s dlouhým řetězcem (LCB)..
Nejběžnějšími bázemi jsou sfinganin a sfingosin, které se od sebe liší pouze v přítomnosti dvojné vazby trans mezi uhlíky 4 a 5 mastné kyseliny sfingosinu.
Uhlíky 1, 2 a 3 sfingosinu jsou strukturně analogické s uhlíky glycerolu glycerofosfolipidů. Když je mastná kyselina připojena k uhlíku 2 sfingosinu prostřednictvím amidových vazeb, vzniká ceramid, což je molekula velmi podobná diacylglycerolu a představuje nejjednodušší sfingolipid.
Mastné kyseliny s dlouhým řetězcem, které tvoří hydrofobní oblasti těchto lipidů, mohou být velmi rozmanité. Délky se pohybují od 14 do 22 atomů uhlíku, které mohou mít různé stupně nasycení, obvykle mezi uhlíky 4 a 5.
V polohách 4 nebo 6 mohou mít hydroxylové skupiny a dvojné vazby v jiných polohách nebo dokonce větve, jako jsou methylové skupiny.
Vlastnosti
Řetězce mastných kyselin spojené amidovými vazbami s ceramidy jsou obvykle nasycené a mají tendenci být delší než řetězce nalezené v glycerofosfolipidech, což se jeví jako zásadní pro jejich biologickou aktivitu..
Charakteristickým rysem sfingolipidové kostry je to, že mohou mít čistý pozitivní náboj při neutrálním pH, což je mezi lipidovými molekulami vzácné..
Nicméně pKa aminoskupiny je nízká ve srovnání s jednoduchým aminem, mezi 7 a 8, takže část molekuly není nabitá při fyziologickém pH, což by mohlo vysvětlit jejich „volný“ pohyb mezi vrstvami.
Tradiční klasifikace sfingolipidů vyplývá z mnoha modifikací, kterými může molekula ceramidu projít, zejména pokud jde o substituce skupin polární hlavy.
Funkce
Sfingolipidy jsou nezbytné u zvířat, rostlin a hub, stejně jako u některých prokaryotických organismů a virů..
-Strukturální funkce
Sfingolipidy modulují fyzikální vlastnosti membrán, včetně jejich tekutosti, tloušťky a zakřivení. Modulace těchto vlastností jim také poskytuje přímý vliv na prostorovou organizaci membránových proteinů..
V lipidových „raftech“
V biologických membránách lze detekovat dynamické mikrodomény s menší tekutostí, složené z molekul cholesterolu a sfingolipidů nazývaných lipidové rafty..
Tyto struktury se vyskytují přirozeně a úzce souvisí s integrálními proteiny, receptory buněčného povrchu a signálními proteiny, transportéry a jinými proteiny s kotvami glykosylfosfatidylinositolu (GPI)..
-Signalizační funkce
Mají funkce jako signální molekuly, které fungují jako druzí poslové nebo jako vylučované ligandy pro receptory buněčného povrchu..
Jako sekundární poslové se mohou podílet na regulaci homeostázy vápníku, růstu buněk, tumorigenezi a potlačení apoptózy. Kromě toho aktivita mnoha integrálních a periferních membránových proteinů závisí na jejich asociaci se sfingolipidy..
Mnoho interakcí mezi buňkami a buňkou s jejím prostředím závisí na vystavení různých polárních skupin sfingolipidů vnějšímu povrchu plazmatické membrány..
Vazba glykosfingolipidů a lektinů je zásadní pro asociaci myelinu s axony, adhezi neutrofilů k endotelu atd..
Vedlejší produkty metabolismu
Nejdůležitější signální sfingolipidy jsou báze s dlouhým řetězcem nebo sfingosiny a ceramidy, jakož i jejich fosforylované deriváty, jako je sfingosin-1-fosfát.
Metabolické produkty mnoha sfingolipidů aktivují nebo inhibují několik navazujících cílů (proteinové kinázy, fosfoproteinové fosfatázy a další), které řídí komplexní buněčné chování, jako je růst, diferenciace a apoptóza..
-Jako receptory na membráně
Některé patogeny používají glykosfingolipidy jako receptory ke zprostředkování jejich vstupu do hostitelských buněk nebo k dodání faktorů virulence..
Ukázalo se, že sfingolipidy se účastní mnoha buněčných událostí, jako je sekrece, endocytóza, chemotaxe, neurotransmise, angiogeneze a zánět..
Podílejí se také na transportu membrán, čímž ovlivňují internalizaci receptorů, uspořádání, pohyb a fúzi sekrečních vezikul v reakci na různé podněty..
Sfingolipidové skupiny
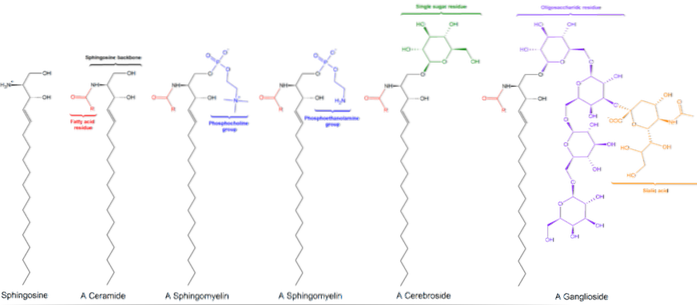
Existují tři podtřídy sfingolipidů, všechny odvozené od ceramidu a navzájem se lišící polárními skupinami, jmenovitě: sfingomyeliny, glykolipidy a gangliosidy..
Sfingomyeliny

Ty obsahují fosfocholin nebo fosfoethanolamin jako skupinu polárních hlav, a proto jsou spolu s glycerofosfolipidy klasifikovány jako fosfolipidy. Samozřejmě připomínají fosfatidylcholiny v trojrozměrné struktuře a obecných vlastnostech, protože na svých polárních hlavách nemají náboj..
Jsou přítomny v plazmatických membránách zvířecích buněk a jsou zvláště bohaté na myelin, plášť, který obklopuje a izoluje axony některých neuronů.
Neutrální glykolipidy nebo glykosfingolipidy (bez poplatku)
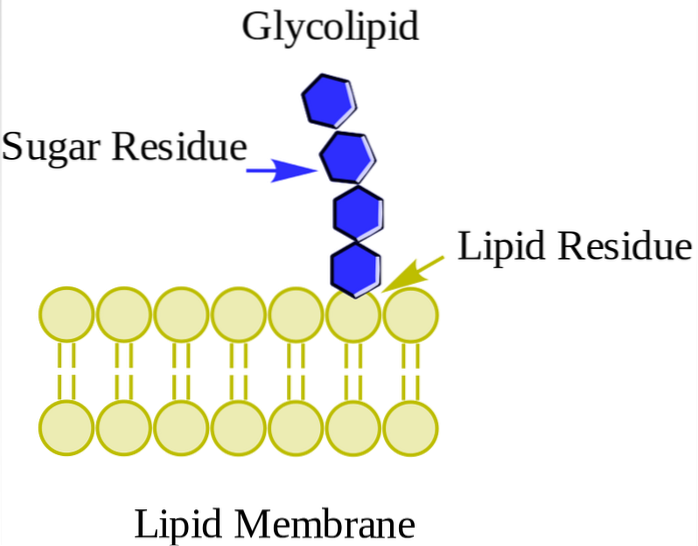
Nacházejí se primárně na vnější straně plazmatické membrány a mají jeden nebo více cukrů jako skupina polárních hlaviček připojených přímo k hydroxylové skupině uhlíku 1 části ceramidu. Nemají fosfátové skupiny. Protože při pH 7 nemají náboj, říká se jim neutrální glykolipidy.
Cerebrosidy mají jedinou molekulu cukru připojenou k ceramidu. Ty, které obsahují galaktózu, se nacházejí v plazmatických membránách buněk jiných než nervových tkání. Globosidy jsou glykosfingolipidy se dvěma nebo více cukry, obvykle D-glukózou, D-galaktózou nebo N-acetyl-D-galaktosaminem..
Kyselé gangliosidy nebo glykosfingolipidy
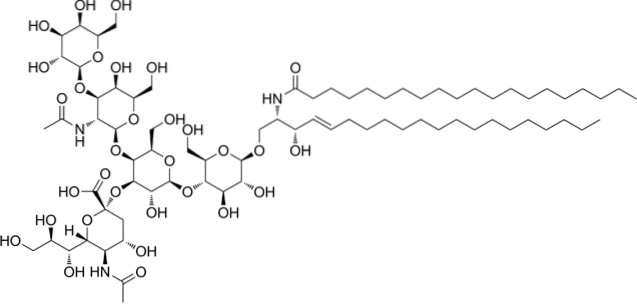
Jedná se o nejsložitější sfingolipidy. Mají oligosacharidy jako skupinu polárních hlav a jeden nebo více koncových zbytků kyseliny N-acetylmuramové, také nazývaných kyselina sialová. Kyselina sialová dává gangliosidům negativní náboj při pH 7, což je odlišuje od neutrálních glykosfingolipidů.
Nomenklatura této třídy sfingolipidů závisí na množství zbytků kyseliny sialové přítomných v oligosacharidové části polární hlavy..
Syntéza
Molekula báze s dlouhým řetězcem neboli sfingosin je syntetizována v endoplazmatickém retikulu (ER) a přidání polární skupiny k hlavě těchto lipidů nastává později v komplexu Golgi. U savců se může určitá syntéza sfingolipidů vyskytnout také v mitochondriích.
Po dokončení syntézy v komplexu Golgi jsou sfingolipidy transportovány do dalších buněčných kompartmentů prostřednictvím mechanismů zprostředkovaných vezikuly..
Biosyntéza sfingolipidů se skládá ze tří základních událostí: syntéza bází s dlouhým řetězcem, biosyntéza ceramidů spojením mastné kyseliny prostřednictvím amidové vazby a nakonec tvorba komplexních sfingolipidů spojením polárních skupin na uhlíku 1 základny sfingoidů.
Kromě syntézy de novo, sfingolipidy mohou také vznikat přeměnou nebo recyklací bází s dlouhým řetězcem a ceramidů, které mohou napájet kaluž sfingolipidů.
Syntéza kostry ceramidu
Biosyntéza ceramidu, páteře sfingolipidů, začíná dekarboxylativní kondenzací molekuly palmitoyl-CoA a L-serinu. Reakce je katalyzována heterodimerní serinpalmitoyltransferázou (SPT) v závislosti na pyridoxal fosfátu a produktem je 3-keto dihydrosphingosin..
Tento enzym je inhibován β-halogen-L-alaniny a L-cykloseriny. V kvasinkách je kódován dvěma geny, zatímco u savců existují tři geny pro tento enzym. Aktivní místo se nachází na cytoplazmatické ploše endoplazmatického retikula.
Role tohoto prvního enzymu je zachována ve všech studovaných organismech. Mezi taxony však existují určité rozdíly, které souvisejí s subcelulárním umístěním enzymu: bakterie jsou cytoplazmatické, kvasinky, rostliny a zvířata jsou v endoplazmatickém retikulu.
3-ketosfinganin je následně redukován 3-ketosfinganin reduktázou závislou na NADPH za vzniku sfinganinu. Dihydroceramid syntáza (sfinganin N-acyl transferáza) poté acetyluje sfinganin za vzniku dihydroceramidu. Ceramid je poté tvořen dihydroceramid desaturázou / reduktázou, která vloží dvojnou vazbu trans v poloze 4-5.
U savců existuje řada izoforem ceramid syntáz, z nichž každá váže specifický řetězec mastných kyselin na báze s dlouhým řetězcem. Ceramidové syntázy a další enzymy, elongázy, proto představují hlavní zdroj rozmanitosti mastných kyselin ve sfingolipidech..
Specifická tvorba sfingolipidů
Sfingomyelin je syntetizován přenosem fosfocholinu z fosfatidylcholinu na ceramid za uvolnění diacylglycerolu. Reakce váže sfingolipidové a glycerofosfolipidové signální dráhy.
Fosfoethanolamin ceramid se syntetizuje z fosfatidylethanolaminu a ceramidu v analogické reakci jako syntéza sfingomyelinu a jakmile se vytvoří, může se methylovat na sfingomyelin. Inositolfosfátové ceramidy se tvoří transesterifikací z fosfatidylinositolu.
Glykosfingolipidy jsou modifikovány hlavně v komplexu Golgi, kde se specifické glykosyltransferázové enzymy účastní přidání oligosacharidových řetězců v hydrofilní oblasti ceramidového skeletu..
Metabolismus
Odbourávání sfingolipidů se provádí pomocí enzymů glukohydroláz a sfingomyelináz, které mají na starosti odstranění modifikací polárních skupin. Na druhé straně ceramidázy regenerují báze s dlouhým řetězcem z ceramidů.
Gangliosidy jsou degradovány řadou lysozomálních enzymů, které katalyzují postupnou eliminaci cukrových jednotek a nakonec produkují ceramid..
Další degradační cesta spočívá v internalizaci sfingolipidů v endocytických vezikulách, které jsou odeslány zpět do plazmatické membrány nebo transportovány do lysozomů, kde jsou degradovány specifickými kyselými hydrolázami..
Ne všechny báze s dlouhým řetězcem jsou recyklovány, endoplazmatické retikulum má cestu pro jejich terminální degradaci. Tento degradační mechanismus spočívá ve fosforylaci namísto acylace LCB, což vede ke vzniku signálních molekul, které mohou být rozpustnými substráty pro lyázové enzymy, které štěpí LCB-fosfát za vzniku acyloaldehydů a fosfoethanolaminu..
Nařízení
Metabolismus těchto lipidů je regulován na různých úrovních, jednou z nich je enzym zodpovědný za syntézu, jejich posttranslační modifikace a jejich alosterické mechanismy..
Některé regulační mechanismy jsou buněčně specifické, a to buď pro řízení okamžiku vývoje buňky, ve kterém jsou produkovány, nebo v reakci na specifické signály..
Reference
- Bartke, N., & Hannun, Y. (2009). Bioaktivní sfingolipidy: metabolismus a funkce. Journal of Lipid Research, padesátka, 19.
- Breslow, D. K. (2013). Sfingolipidová homeostáza v endoplazmatickém retikule a dále. Perspektivy Cold Spring Harbor v biologii, 5(4), a013326.
- Futerman, A. H., & Hannun, Y. A. (2004). Složitý život jednoduchých sfingolipidů. Zprávy EMBO, 5(8), 777-782.
- Harrison, P. J., Dunn, T., a Campopiano, D. J. (2018). Biosyntéza sfingolipidů u člověka a mikrobů. Zprávy o přírodních produktech, 35(9), 921-954.
- Lahiri, S., a Futerman, A. H. (2007). Metabolismus a funkce sfingolipidů a glykosfingolipidů. Buněčné a molekulární vědy o životě, 64(17), 2270-2284.
- Lodish, H., Berk, A., Kaiser, C. A., Krieger, M., Bretscher, A., Ploegh, H., Martin, K. (2003). Molekulární buněčná biologie (5. vydání). Freeman, W. H. & Company.
- Luckey, M. (2008). Membránová strukturní biologie: s biochemickými a biofyzikálními základy. Cambridge University Press. Citováno z www.cambridge.org/9780521856553
- Merrill, A. H. (2011). Sfingolipidové a glykosfingolipidové metabolické dráhy v době sfingolipidomiky. Chemické recenze, 111(10), 6387-6422.
- Nelson, D. L. a Cox, M. M. (2009). Lehningerovy principy biochemie. Edice Omega (5. vydání).
- Vance, J. E., a Vance, D. E. (2008). Biochemie lipidů, lipoproteinů a membrán. v New Comprehensive Biochemistry Vol.36 (4. vydání). Elsevier.

Zatím žádné komentáře