
Terciární struktura hlavních charakteristických proteinů
The terciární struktura proteinů Je to trojrozměrná konformace, kterou polypeptidové řetězce získávají, když se skládají na sebe. Tato konformace se objevuje interakcemi mezi postranními řetězci aminokyselinových zbytků polypeptidu. Boční řetězce mohou interagovat bez ohledu na jejich polohu v proteinu.
Protože to závisí na interakcích mezi skupinami R, terciární struktura vykazuje neopakující se aspekty řetězce, protože tyto skupiny jsou pro každý aminokyselinový zbytek odlišné. Na druhé straně sekundární struktura závisí na karboxylových a amino skupinách, které jsou přítomny ve všech aminokyselinách.
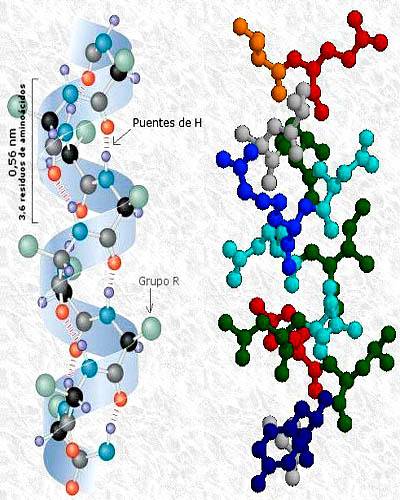
Terciární struktura protein kinázy fosfatázy se sekundárními strukturami v alfa šroubovici a beta listu. Převzato a upraveno z: A2-33. Změněno Alejandro Porto. [CC BY-SA 3.0 (https://creativecommons.org/licenses/by-sa/3.0)].
Někteří autoři naznačují, že vláknité proteiny mají jednoduchou terciární strukturu, avšak jiní autoři poukazují na to, že tato struktura je typická pro globulární proteiny..
Rejstřík článků
- 1 Vláknité bílkoviny
- 1,1 α-keratiny
- 1,2 β-keratiny
- 1.3 Kolagen
- 1.4 Jiné vláknité proteiny
- 2 Globulární proteiny
- 2.1 Charakteristika terciární struktury globulárních proteinů
- 2.2 Obecná pravidla skládání globulárních proteinů
- 3 Denaturace bílkovin
- 4 Odkazy
Vláknité proteiny
Ve vláknitých proteinech jsou polypeptidové řetězce uspořádány ve formě dlouhých vláken nebo dlouhých listů; obvykle jsou tvořeny jediným typem sekundární struktury. Tato sekundární struktura je ve většině případů při určování tvaru proteinu důležitější než terciární struktura..
Jeho biologická funkce je strukturální, dodává sílu a / nebo pružnost orgánům a strukturám, kde se nacházejí, a udržuje je pohromadě. Všechny vláknité proteiny jsou nerozpustné ve vodě kvůli velkému množství hydrofobních aminokyselinových zbytků, které obsahují.
Tyto vláknité proteiny zahrnují keratiny a kolagen. První se nacházejí v pojivových tkáních a ve strukturách, jako jsou vlasy, nehty (α-keratiny), šupiny a peří (β-keratiny). Kolagen se nachází mimo jiné v kostech, šlachách a kůži.
α-keratiny
Tyto proteiny jsou součástí takzvaných proteinů se středními vlákny, které hrají důležitou roli v cytoskeletu mnohobuněčných organismů. Kromě toho jsou hlavní složkou vlasů, nehtů, vlny, rohů, kopyt a jednoho z hlavních proteinů zvířecí kůže..
Struktura molekuly je α šroubovice. Dva a-keratinové řetězce mohou být uspořádány paralelně a navinuty jeden přes druhý s jejich hydrofobními R skupinami, které na sebe vzájemně působí. Tímto způsobem se vytvoří superhelikální struktura nebo koule s levotočivým navíjením..
Terciární struktura α-keratinu je jednoduchá a dominuje jí sekundární struktura α-šroubovice. Na druhou stranu je také přítomna kvartérní struktura, protože dvě molekuly se účastní superhelikální struktury, které interagují prostřednictvím nekovalentních vazeb..
β-keratiny
Primární struktura je podobná jako u α-keratinů, ale jejich sekundární struktuře dominují β listy. Jsou hlavní složkou šupin plazů a ptačího peří..
Kolagen
Tento protein může představovat více než 30% celkové proteinové hmoty některých zvířat. Nachází se mimo jiné v chrupavkách, kostech, šlachách, rohovce a kůži.
Sekundární struktura kolagenu je jedinečná a je představována levotočivou šroubovice s 3,3 aminokyselinovými zbytky pro každé kolo. Tři levotočivé spirálové řetězy (α-řetězy) se omotávají kolem sebe, čímž vzniká pravotočivá nadšroubovicová molekula, kterou někteří autoři nazývají tropokolagen..
Molekuly tropokolagenu se spojily a vytvořily kolagenové vlákno, které má vysokou pevnost, lepší než pevnost oceli a srovnatelnou s vysokou pevností mědi.
Jiné vláknité proteiny
Jiné typy vláknitých proteinů jsou fibroin a elastin. První je tvořen β vrstvami, které se skládají převážně z glycinu, alaninu a serinu..
Postranní řetězce těchto aminokyselin mají malou velikost, takže mohou být pevně zabaleny. Výsledkem je vlákno, které je jak velmi odolné, tak velmi málo roztažitelné..
V elastinu nahrazuje valin serin mezi jeho hlavními složkami aminokyselin. Na rozdíl od fibroinu je elastin velmi roztažitelný, proto jeho název. Při tvorbě molekuly působí také lysin, který se může podílet na síťování, které umožňuje elastinu znovu získat svůj tvar, když napětí ustane.
Globulární proteiny
Globulární proteiny, na rozdíl od vláknitých, jsou rozpustné a obecně mají několik typů sekundárních struktur. V nich jsou však důležitější trojrozměrné konformace, které získají při skládání na sebe (terciární struktura).
Tyto konkrétní trojrozměrné konformace propůjčují každému proteinu specifickou biologickou aktivitu. Hlavní funkce těchto proteinů je regulační, jak je tomu u enzymů.
Charakteristika terciární struktury globulárních proteinů
Terciární struktura globulárních proteinů má některé důležité vlastnosti:
- Globulární proteiny jsou kompaktní díky balení složením polypeptidového řetězce.
- Vzdálené aminokyselinové zbytky v primární struktuře polypeptidových řetězců zůstávají těsně vedle sebe a jsou schopné vzájemné interakce díky skládání.
- Větší globulární proteiny (více než 200 aminokyselin) mohou mít několik kompaktních segmentů, nezávisle na sobě a se zvláštními funkcemi, a každý z těchto segmentů se nazývá doména. Doména může mít mezi 50 a 350 aminokyselinovými zbytky.
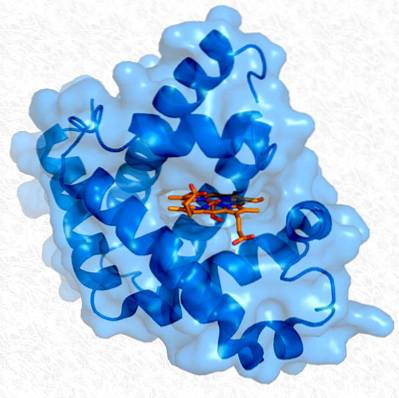
Terciární struktura myoglobinu. Převzato a upraveno od: Thomas Splettstoesser. Změněno Alejandro Porto. [CC BY-SA 3.0 (https://creativecommons.org/licenses/by-sa/3.0)].
Obecná pravidla skládání globulárních proteinů
Jak již bylo uvedeno, proteiny představují konkrétní formy skládání, které jim také dávají zvláštní vlastnosti. Toto skládání není náhodné a je upřednostňováno jak primární, tak sekundární strukturou a některými nekovalentními interakcemi, a existují také některá fyzická omezení skládání, pro která byla formulována některá pravidla:
- Všechny globulární proteiny mají definované distribuční vzorce, přičemž hydrofobní R skupiny směřují dovnitř molekuly a hydrofilní zbytky ve vnější vrstvě. To vyžaduje alespoň dvě vrstvy sekundární struktury. Smyčka β-α-β a vrchol α-α mohou poskytnout tyto dvě vrstvy.
- Β-listy jsou obecně uspořádány v levé ruce válcované formě..
- V polypeptidovém řetězci mohou nastat různé obraty, které přecházejí z jedné sekundární struktury do druhé, jako jsou β nebo γ obraty, které mohou obrátit směr řetězce o čtyři aminokyselinové zbytky nebo méně..
- Globulární proteiny mají α-helixy, β-listy, obraty a nepravidelně strukturované segmenty.
Denaturace bílkovin
Pokud protein ztratí svou přirozenou (přirozenou) trojrozměrnou strukturu, ztratí svou biologickou aktivitu a většinu svých specifických vlastností. Tento proces je znám pod názvem denaturace.
K denaturaci může dojít, když se změní přirozené podmínky prostředí, například změnou teploty nebo pH. Tento proces je u mnoha proteinů nevratný; ostatní však mohou spontánně obnovit svou přirozenou strukturu, když se obnoví normální podmínky prostředí..
Reference
- C.K. Mathews, K.E. van Holde & K.G. Ahern (2002). Biochemie. 3. vydání. Benjamin / Cummings Publishing Company, Inc..
- R. Murray, P. Mayes, D.C. Granner & V.W. Rodwell (1996). Harperova biochemie. Appleton & Lange.
- J.M. Berg, J.L. Tymoczko a L. Stryer (2002). Biochemie. 5. vydání. W. H. Freeman and Company.
- W.M. Becker, L.J. Kleinsmith & J. Hardin (2006) World of the Cell. 6. vydání. Pearson Education Inc..
- A. Lehninger (1978). Biochemie. Ediciones Omega, S.A.
- T. McKee & J.R. McKee (2003). Biochemie: Molekulární podstata života. 3. vydání. Společnost McGraw-HiII Companies, Inc..



Zatím žádné komentáře