
Struktura, vlastnosti, použití a rizika etanu
The etan je jednoduchý uhlovodík vzorce C.dvaH6 s bezbarvým přírodním plynem bez zápachu, který má velmi cenné a různorodé použití při syntéze ethylenu. Kromě toho je to jeden z pozemských plynů, který byl také detekován na jiných planetách a hvězdných tělesech kolem sluneční soustavy. Objevil jej vědec Michael Faraday v roce 1834.
Mezi velkým počtem organických sloučenin tvořených atomy uhlíku a vodíku (známými jako uhlovodíky) jsou ty, které jsou v plynném stavu při okolních teplotách a tlacích, které jsou široce používány v mnoha průmyslových odvětvích..
Obvykle pocházejí z plynné směsi zvané „zemní plyn“, produkt, který má pro lidstvo vysokou hodnotu, a tvoří mimo jiné alkany typu methanu, etanu, propanu a butanu; klasifikován podle počtu atomů uhlíku v řetězci.
Rejstřík článků
- 1 Chemická struktura
- 1.1 Syntéza etanu
- 2 Vlastnosti
- 2.1 Rozpustnost etanu
- 2.2 Krystalizace etanu
- 2.3 Spalování etanu
- 2.4 Ethan v atmosféře a v nebeských tělesech
- 3 použití
- 3.1 Výroba ethylenu
- 3.2 Základní chemická tvorba
- 3.3 Chladivo
- 4 Rizika etanu
- 5 Reference
Chemická struktura
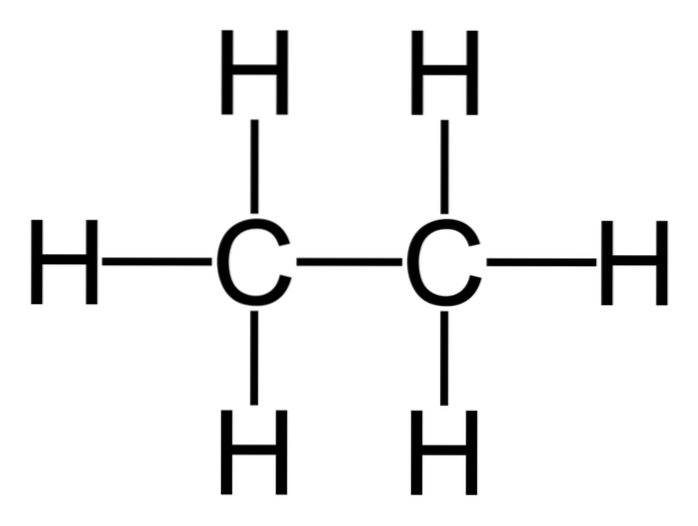
Ethan je molekula vzorce C.dvaH6, obvykle viděn jako spojení dvou methylových skupin (-CH3) za vzniku uhlovodíku z jedné vazby uhlík-uhlík. Je to také nejjednodušší organická sloučenina po metanu, vyjádřená takto:
H3C-CH3
Atomy uhlíku v této molekule mají hybridizaci sp-typu3, takže molekulární vazby představují volnou rotaci.
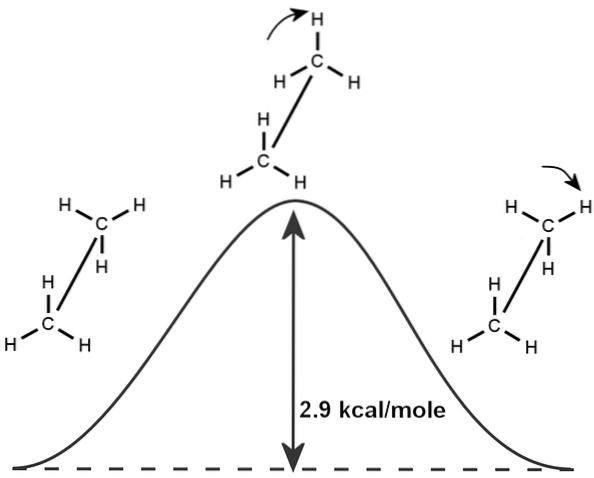
Podobně existuje přirozený jev etanu, který je založen na rotaci jeho molekulární struktury a minimální energii potřebné k vytvoření rotace vazby o 360 stupňů, kterou vědci nazývají „etanová bariéra“.
Z tohoto důvodu se ethan může objevit v různých konfiguracích v závislosti na jeho rotaci, i když jeho nejstabilnější konformace existuje tam, kde jsou vodíky naproti sobě (jak je vidět na obrázku).
Syntéza etanu
Ethan lze snadno syntetizovat z Kolbeho elektrolýzy, což je organická reakce, při které dochází ke dvěma krokům: elektrochemická dekarboxylace (odstranění karboxylové skupiny a uvolnění oxidu uhličitého) dvou karboxylových kyselin a kombinace meziproduktů produktů za vzniku kovalentní vazby.
Podobně elektrolýza kyseliny octové vede k tvorbě etanu a oxidu uhličitého a tato reakce se používá k její syntéze..
Oxidace anhydridu kyseliny octové působením peroxidů, což je koncept podobný konceptu Kolbeho elektrolýzy, má za následek také tvorbu etanu..
Stejným způsobem jej lze účinně oddělit od zemního plynu a metanu zkapalňovacím procesem, přičemž se k zachycení tohoto plynu a jeho oddělení od směsí s jinými plyny využívají kryogenní systémy..
Pro tuto roli je upřednostňován proces expanze turba: směs plynů prochází turbínou a generuje její expanzi, dokud její teplota neklesne pod -100 ° C.
Již v tomto bodě lze složky směsi rozlišit, takže kapalný ethan bude oddělen od plynného metanu a dalších druhů zapojených pomocí destilace.
Vlastnosti
Ethan se v přírodě vyskytuje jako bez zápachu a bezbarvý plyn při standardních tlacích a teplotách (1 atm a 25 ° C). Má bod varu -88,5 ° C a bod tání -182,8 ° C. Rovněž na něj nemá vliv vystavení silným kyselinám nebo zásadám..
Rozpustnost etanu
Molekuly etanu jsou symetrické v konfiguraci a mají slabé přitažlivé síly, které je drží pohromadě, nazývané disperzní síly..
Při pokusu o rozpuštění etanu ve vodě jsou přitažlivé síly vytvořené mezi plynem a kapalinou velmi slabé, takže je velmi obtížné vázat etan s molekulami vody..
Z tohoto důvodu je rozpustnost etanu značně nízká a při zvýšení tlaku v systému se mírně zvyšuje..
Krystalizace etanu
Ethan lze ztuhnout, což vede k tvorbě nestabilních krystalů etanu s krychlovou krystalickou strukturou..
S poklesem teploty nad -183,2 ° C se tato struktura stává monoklinickou, což zvyšuje stabilitu její molekuly.
Spalování etanu
Tento uhlovodík, i když není široce používán jako palivo, lze použít ve spalovacích procesech k výrobě oxidu uhličitého, vody a tepla, což je znázorněno následovně:
2 C.dvaH6 + 7Odva → 4COdva + 6HdvaO + 3120 kJ
Existuje také možnost spalování této molekuly bez přebytku kyslíku, což se označuje jako „neúplné spalování“, což má za následek tvorbu amorfního uhlíku a oxidu uhelnatého v nežádoucí reakci v závislosti na množství použitého kyslíku:
2 C.dvaH6 + 3Odva → 4C + 6HdvaO + teplo
2 C.dvaH6 + 4. místodva → 2C + 2CO + 6HdvaO + teplo
2 C.dvaH6 + 5Odva → 4CO + 6HdvaO + teplo
V této oblasti dochází ke spalování řadou reakcí volných radikálů, které jsou počítány do stovek různých reakcí. Například při neúplných spalovacích reakcích mohou vznikat sloučeniny, jako je formaldehyd, acetaldehyd, methan, methanol a ethanol..
To bude záviset na podmínkách, za kterých reakce probíhá, a na reakcích volných radikálů. Ethylen lze také tvořit při vysokých teplotách (600-900 ° C), což je průmyslově velmi žádaný produkt..
Ethan v atmosféře a v nebeských tělesech
Ethan je v atmosféře planety Země stopový a existuje podezření, že se lidem podařilo tuto koncentraci zdvojnásobit od doby, kdy začali praktikovat průmyslové činnosti.
Vědci se domnívají, že velká část současné přítomnosti etanu v atmosféře je způsobena spalováním fosilních paliv, ačkoli celosvětové emise etanu se snížily téměř o polovinu od zlepšení technologií výroby břidlicového plynu (zdroj zemního plynu).
Tento druh je také přirozeně produkován účinkem slunečního světla na atmosférický metan, který se rekombinuje a tvoří molekulu etanu.
Tekutý etan existuje na povrchu Titanu, jednoho ze Saturnových měsíců. K tomu dochází ve větším množství v řece Vid Flumina, která teče více než 400 kilometrů k jednomu z jejích moří. Tato sloučenina byla také prokázána na kometách a na povrchu Pluta.
Aplikace
Výroba ethylenu
Použití etanu je založeno hlavně na výrobě ethylenu, organického produktu, který se ve světové výrobě používá nejvíce, prostřednictvím procesu známého jako krakování v parní fázi..
Tento proces spočívá v průchodu přívodu etanu zředěného párou do pece a jeho rychlém zahřátí bez kyslíku..
Reakce probíhá při extrémně vysoké teplotě (mezi 850 a 900 ° C), ale doba zdržení (doba, kterou ethan stráví v peci) musí být krátká, aby byla reakce účinná. Při vyšších teplotách se vytváří více ethylenu.
Základní chemická tvorba
Ethan byl také studován jako hlavní složka při tvorbě základních chemikálií. Oxidační chlorace je jedním z postupů navržených k získání vinylchloridu (složky z PVC), který nahrazuje jiné méně hospodárné a komplikovanější.
Chladivo
Nakonec se etan používá jako chladivo v běžných kryogenních systémech, což také ukazuje schopnost zmrazit malé vzorky v laboratoři pro analýzu..
Je to velmi dobrá náhrada vody, která déle ochladí jemné vzorky a může také způsobit tvorbu škodlivých ledových krystalů..
Rizika etanu
-Ethan má schopnost vznítit se, hlavně když se váže na vzduch. Při obsahu 3,0 až 12,5% etanu ve vzduchu se může vytvořit výbušná směs.
-Může omezit kyslík ve vzduchu, ve kterém se nachází, a proto představuje rizikový faktor udušení pro přítomné a exponované lidi a zvířata.
-Ethan ve zmrazené kapalné formě může při přímém kontaktu s pokožkou vážně popálit a také působit jako kryogenní médium pro jakýkoli předmět, kterého se dotkne, a okamžitě ji zmrazí.
-Výpary kapalného etanu jsou těžší než vzduch a koncentrují se na zemi, což může představovat riziko vznícení, které může způsobit řetězovou reakci spalování.
-Požití etanu může způsobit nevolnost, zvracení a vnitřní krvácení. Vdechování kromě udušení způsobuje bolesti hlavy, zmatenost a změny nálady. Smrt na srdeční zástavu je možná při vysokých expozicích.
-Představuje skleníkový plyn, který společně s metanem a oxidem uhličitým přispívá ke globálnímu oteplování a změně klimatu způsobené znečištěním lidmi. Naštěstí je méně hojný a odolný než metan a absorbuje méně záření než metan..
Reference
- Britannica, E. (s.f.). Etan. Obnoveno z britannica.com
- Nes, G. V. (s.f.). Monokrystalické struktury a distribuce elektronové hustoty ethanu, ethylenu a acetylenu. Obnoveno z rug.nl
- Weby, G. (s.f.). Ethan: Zdroje a jímky. Obnoveno z sites.google.com
- SoftSchools. (s.f.). Ethanový vzorec. Obnoveno z softschools.com
- Wikipedia. (s.f.). Etan. Citováno z en.wikipedia.org


Zatím žádné komentáře