
Vlastnosti a příprava bakteriálního nátěru
The bakteriální nátěr je tenkovrstvý nástavec suspenze bakteriálních mikroorganismů vyrobený na průhledné skleněné desce nebo podložním sklíčku pro pozorování pod optickým mikroskopem.
Prodloužení ve formě filmu se provádí za účelem co největšího oddělení mikroorganismů, protože pokud jsou seskupeny, pozorování není jasné.
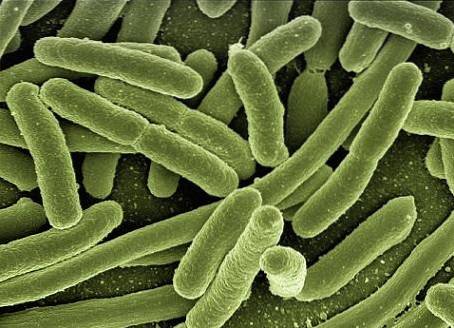
Při studiu bakteriálních kultur se k jejich lepší analýze používají techniky přípravy, fixace a barvení nátěrů. Vzhledem k malé velikosti mikroorganismů je pro jejich pozorování nezbytně nutné použití optického mikroskopu..
Optické mikroskopy jsou nepostradatelným nástrojem pro pozorování šmouh. Využívají optické čočky a světlo umožňující sledování vzorků s velkým zvětšením..
Živé buňky obecně nemají většinou barevné struktury, viděné ve světelném mikroskopu jsou to bezbarvé, průhledné vzorky a vykazují velmi malý vnitřní kontrast a prostředí..
Pozorování pomocí jednoduchého optického mikroskopu s jasným polem bez použití pomocných barvicích technik je velmi omezené a používá se pouze v některých případech, například při pozorování pohybu mikroorganismů.
Pro optimální pozorování mikroorganismů je třeba dosáhnout rovnováhy mezi kontrastem a rozlišením. Detaily buněk nelze pod mikroskopem vidět, ani při vysokém rozlišení; použití barviv je vyžadováno barvicími technikami, které poskytují kontrast pro pozorování.
Rejstřík článků
- 1 Vlastnosti kvalitního bakteriálního nátěru
- 1.1 Vynikající kontrast
- 1.2 Dobrá fixace
- 1.3 Dobré barvení
- 2 Příprava
- 2.1 A. Stěr
- 2.2 B. Fixace
- 2.3 C. Jednoduché barvení
- 2.4 D. Definitivní zachování nátěru
- 3 Odkazy
Vlastnosti kvalitního bakteriálního nátěru
Vynikající kontrast
K dosažení vynikajícího kontrastu existují sofistikované mikroskopy mikroskop s fázovým kontrastem, mikroskop s diferenciální interferencí a mikroskop s tmavým polem. Tento typ mikroskopu se používá mimo jiné k pozorování bakteriálních struktur, jako jsou pláště a vlákna..
Barvení je jednoduchá technika ke zvýšení kontrastu, kterého je dosaženo pomocí mikroskopu ve světlém poli. V této technice lze použít různá barviva, která významně zlepšují mikroskopické pozorování..
Skvrny se provádějí přímo na nátěry nebo nástavce suspenzí mikroorganismů na podložních sklíčcích, předem vysušené a fixované..
Dobrá oprava
Fixace je technika používaná k zachování buněčných struktur; způsobuje inaktivaci mikroorganismů a adhezi ke sklu sklíčka. Existují různé způsoby fixace: tepelná fixace a chemická fixace.
Tepelná fixace
Toto je nejpoužívanější metoda pro pozorování bakteriálních nátěrů. Tato technika spočívá v průchodu bakteriální suspenze nátěru plamenem zapalovače. Tato technika je schopna zachovat vnější morfologii bakterií, ale ničí jejich vnitřní struktury..
Chemická fixace
Chemická fixace používá konzervační chemikálie, jako je například formaldehyd nebo formaldehyd, ethanol a kyselina octová. Výhodou použití chemických fixačních činidel je to, že je dosaženo zachování vnitřních buněčných struktur mikroorganismů..
Dobré barvení
Nejběžnějšími postupy pro barvení dříve vysušeného a fixovaného nátěru jsou pozitivní nebo jednoduché barvení, diferenciální barvení a negativní barvení. Existují také speciální techniky pro barvení konkrétních buněčných struktur (kapsle, spory, bičíky).
Pozitivní barvení nebo jednoduché barvení
Pozitivní nebo jednoduché barvení je nejrozšířenější technikou barvení stěrem. Používá barviva, která mají schopnost vázat se na určité mikrobiální struktury, což umožňuje jejich pozorování pod mikroskopem.
Tato barviva mají ve své chemické struktuře chromoforové skupiny (barevná část) se střídáním dvojných vazeb a jednoduchých vazeb (konjugace). Tyto vazby mohou zase navázat iontové nebo kovalentní vazby s některými buněčnými strukturami..
Barvy použité při pozitivním nebo jednoduchém barvení jsou většinou chemické deriváty anilin (barevné organické soli).
Na druhou stranu mezi barvivy najdeme některá se zásaditým pH a jiná s kyselým pH..
Základní barviva
U základních barviv má skupina chromoforů kladný elektrický náboj. Drtivá většina prokaryotických mikroorganismů má neutrální vnitřní pH a jejich povrch buněk je negativně nabitý. Touto elektrostatickou interakcí se chromofor váže na buňku a obarví ji.
Příklady základních barviv jsou methylenová modř, křišťálově fialová, malachitová zeleň, bazický fuscin, safranin a další..
Kyselinová barviva
V kyselých barvivech má chromoforová skupina záporný elektrický náboj. Ty se používají k barvení proteinů pozitivně nabitými aminoskupinami. Příklady kyselých barviv jsou kyselý fuscin, bengálská růže, konžská červeň a eosin.
Diferenciální barvení
Technika diferenciálního barvení spočívá v aplikaci dvou barviv různé barvy nebo intenzity, aby se pod mikroskopem rozlišily různé mikroorganismy. Gramové barvení a barvení na odolnost vůči kyselinám a alkoholům jsou v bakteriologii nejpoužívanějšími rozdílnými barvivy.
Gramovo barvení se používá jako předběžný test ke zjištění tvaru, velikosti, seskupení buněk a typu buněčné stěny. Pomocí testu Gramova barvení se bakterie buněčné stěny klasifikují na Gram pozitivní bakterie a Gram negativní bakterie..
Negativní barvení
V této technice se používají chemická barviva, která nepronikají dovnitř buňky, ale vytvářejí médium, ve kterém jsou mikroorganismy, jako černé pozadí..
Při technice negativního barvení se nátěr vyrábí kapkou indického inkoustu nebo suspenze nigrosinu, která po sušení při pokojové teplotě vytvoří neprůhledný film pro průchod světla. Tímto způsobem jsou mikroorganismy vnímány jako světlé tvary na tmavém pozadí..
Příprava
A. Smear
1. - Sklíčka velmi dobře umyjte, osušte savým papírem a označte je štítky. Na etiketě musí být uveden obsah přípravku, datum a jméno osoby, která jej zpracovávala..
2. - Zapalovač zapalte a očkovací smyčku sterilizujte v plameni, dokud nebude jasně červená.
3. - Nechte rukojeť vychladnout.
4. - Vezměte zkumavku s bakteriální kulturou, sejměte víčko a rychle projděte ústí zkumavky v blízkosti plamene hořáku (plamen).
5. - Vložte očkovací smyčku do zkumavky obsahující bakteriální kulturu a odeberte vzorek.
6. - Pokud je kultura v kapalném médiu, umístěte vzorek odebraný rukojetí do středu podložního sklíčka a opatrně jej rozložte do kruhu o průměru přibližně 2 cm..
7. - Znovu sterilizujte očkovací smyčku.
8. - Nechejte nátěr zaschnout na vzduchu.
9. - Opakujte kroky 3 až 8 třikrát.
10. - Pokud je kultura v pevném médiu, musí se na podložní sklíčko předem umístit kapka destilované vody. To se provádí smícháním malého vzorku kultury odebrané inokulační smyčkou podle pokynů v krocích 2 až 5 (aseptické podmínky).
11. - Nasypte zředěný vzorek kapkou vody na podložní sklíčko a opakujte třikrát.
B. Fixace
1. - Přidejte dvě kapky methanolu nebo absolutního ethanolu do suchých nátěrů - z kultur v kapalném médiu..
2. - Nechejte vyschnout mimo zapalovač.
3. - Pokud nátěr pochází z kultury na pevném médiu, suchý nátěr se zafixuje teplem a 2 až 3krát rychle projde nejteplejší částí lehčího plamene..
4. - Dotkněte se spodní části nátěru hřbetní částí levé ruky (pro praváky, jinak použijte pravou ruku) a zkontrolujte, zda je studená.
C. Jednoduché barvení
1. - Přidejte 2 kapky vybrané skvrny do nátěru a nechte působit po dobu požadovanou ve specifických protokolech pro každou skvrnu (obvykle mezi 1 a 5 minutami).
2.- Některé skvrny vyžadují pro svou aktivaci použití tepla, v takovém případě je třeba při zahřívání sklíčka v zapalovači plamene postupovat velmi opatrně (manipulujte s ním pinzetou a vyvarujte se varu). Přehřátí nátěru může zničit sledované buňky..
3. - Odstraňte přebytečné barvivo promytím destilovanou vodou z pelet. Odstraňte mycí vodu jemným poklepáním na sklíčko na jeho okraji nakloněném na pracovním stole.
4. - Nechte uschnout na vzduchu.
5. - V závislosti na typu pozorování se v této fázi používá krycí sklíčko nebo ne. Krycí sklíčko chrání a zachovává nátěr. Pokud je v této fázi prováděno pozorování ponoření do oleje, nejsou použity krycí sklíčka, ale nátěr nelze zachovat.
D. Definitivní zachování nátěru
1. - Ponořte nátěr postupně do každého z níže uvedených roztoků, minimálně na 5 minut. Účelem těchto „koupelí“ je nechat nátěr zcela dehydratovaný. Každé činidlo by mělo být před zavedením nátěru do další lázně dobře vyčerpáno..
Pořadí dehydratačních lázní je následující:
- Ethanol 70%
- Ethanol 95%
- Čistý aceton
- Směs aceton-oxylol 1: 1
- Xylol
Poté nechte uschnout na vzduchu.
2. - Namontujte krycí sklíčko, nejlépe 22 × 22 mm, pomocí kanadského balzámu nebo jiného montážního média.
Reference
- Briggs, G. (1965). Příčinné faktory při mikrobiologických laboratorních nehodách a infekcích. Biologické laboratoře americké armády. Fort detrick.
- Cappucino, J.G. a Welch, C.T. (2017). Mikrobiologie: Laboratorní příručka. Pearson.
- Holt, J.G. Editor. (1977). Kratší Bergeyho manuál determinativní bakteriologie. 8th Baltimore: The Williams and Wilkins Co..
- Johnson, T.R. a případ; C.L. (2018). Laboratorní experimenty v mikrobiologii. Pearson.
- Tille, P. (2017). Diagnostická mikrobiologie. 14th St. Louis, USA: Elsiever, Inc..



Zatím žádné komentáře