
Vlastnosti Helicobacter pylori, morfologie, stanoviště
Helicobacter pylori je to gramnegativní šroubovicová bakterie, která se podílí na rozvoji gastritidy, peptických vředů a souvisí s rakovinou žaludku. Objevili jej v roce 1983 australští patologové Robin Warren a Barry Marshall při zkoumání žaludeční sliznice z lidských žaludků..
Marshall dokonce experimentoval sám se sebou, požíval materiál kontaminovaný bakteriemi, kde zjistil, že způsobuje gastritidu, a byl schopen ověřit přítomnost bakterií ve své vlastní biopsii žaludku. Rovněž ověřilo, že reagovalo na antibiotickou léčbu.
Tímto odstranili staré teorie, které tvrdily, že gastritida byla způsobena konzumací kořeněných jídel nebo stresem. Z tohoto důvodu byli v roce 2005 Warrenovi a Marshalovi udělena Nobelova cena za medicínu..
Rejstřík článků
- 1 Obecná charakteristika
- 2 Stanoviště
- 3 Faktory virulence
- 3.1 Flagella
- 3.2 Adhesiny
- 3.3 Lipopolysacharidy (LPS)
- 3.4 Ureáza
- 3.5 Vakuování cytotoxinu (VacA)
- 3.6 Cytotoxin (CagA)
- 3.7 Superoxiddismutáza a kataláza
- 3.8 Indukovatelná syntáza oxidu dusnatého (iNOS):
- 3.9 Fosfolipázy, lipázy a mukinázy
- 4 Taxonomie
- 5 Morfologie
- 6 Diagnóza
- 6.1 - Invazivní metody
- 6.2 - Neinvazivní metody
- 7 Životní cyklus
- 8 Patogeneze
- 8.1 Zánětlivý infiltrát
- 9 Patologie
- 10 Klinické projevy
- 11 Nákaza
- 12 Léčba
- 13 Reference
Obecná charakteristika
Díky své velké podobnosti s rodem Campylobacter byl původně nazýván Campylobacter pyloridis a následně Campylobacter pylori, ale pak to bylo překlasifikováno do nového žánru.
Infekce Helicobacter pylori má širokou distribuci v mnoha převážně zaostalých zemích a je jednou z nejčastějších infekcí u člověka, která se obvykle vyskytuje od dětství.
Předpokládá se, že jakmile je mikroorganismus získán poprvé, může zůstat po celá léta nebo po celý život, v některých případech bez příznaků.
Na druhou stranu se zdá, že žaludek není jediným místem, kde lze mikroorganismus chovat, předpokládá se, že H. pylori se mohou konsolidovat v ústech před kolonizací žaludku.
Stejně tak je možné, že H. pylori přítomné v ústní dutině mohou po léčbě znovu infikovat žaludek. To je podpořeno zjištěním, že některé asymptomatické děti izolovaly mikroorganismus od zubního plaku..
Nicméně, i když infekce Helicobacter pylori je u některých lidí bez příznaků, není neškodný, protože je spojován s 95% duodenálních vředů, 70% peptických vředů a 100% chronické gastritidy v antrálním místě.
Co víc, Helicobacter pylori byl klasifikován jako karcinogen třídy I Mezinárodní agenturou pro výzkum rakoviny pro jeho souvislost mezi infekcí a rakovinou žaludku.
Místo výskytu
Helicobacter pylori nalezen v těchto hostitelích: muž, opice a kočky.
Tato bakterie vyžaduje mikroaerofilní atmosféru (10% COdva, 5% Odva a 85% Ndva) k pěstování, přičemž železo je základním prvkem jeho růstu a metabolismu.
Optimální růstová teplota je 35 až 37 ° C, i když některé kmeny se mohou vyvinout při 42 ° C. Určitý stupeň vlhkosti rovněž zvýhodňuje jeho růst..
Helicobacter pylori roste pomalu v laboratoři a může vyžadovat od 3 do 5 dnů a dokonce až 7 dní, než se kolonie v médiu projeví.
Pro jeho kultivaci lze použít neselektivní médium doplněné krví..
Na druhou stranu, Helicobacter pylori vyznačuje se pohyblivostí a díky svému spirálovitému tvaru umožňuje pohyb šroubovice, jako by byl přišroubován. To mu pomáhá procházet žaludečním hlenem..
Je také pozitivní na katalázu a oxidázu a je velkým producentem ureázy, která plní pro mikroorganismus zásadní funkci. Urease mu umožňuje přežít v prostředí kyselého pH generováním amoniaku, který pomáhá alkalizovat pH.
Mikroorganismus potřebuje k růstu pH 6 až 7. K tomu je kromě používání ureázy nainstalován život pod žaludeční sliznicí, kde ji žaludeční hlen chrání před extrémní kyselostí lumen žaludku (pH 1,0 - 2,0).
Na druhé straně proteázy vylučované bakteriemi modifikují žaludeční hlen, čímž se snižuje možnost difúze kyseliny hlenem..
Faktory virulence
Flagella
Pohyb bakterií představuje faktor virulence, protože mu pomáhá kolonizovat žaludeční sliznici.
Adhesiny
Bakterie představují pilis a fimbrický hemaglutinin, které působí na adherenci mikroorganismu k buňkám žaludku a dvanáctníku.
Adherence je strategie pro bakterie, aby odolávaly peristaltice slizniční vrstvy, kde se nacházejí, aby později migrovaly do epiteliálních buněk.
Na druhé straně specifické hemaglutininy kyseliny sialové na povrchu sliznice zpomalují adhezi a požití H. pylori.
Lipopolysacharidy (LPS)
Je endotoxický jako LPS jiných gramnegativních bakterií. Purifikovaný antigen může vyvolat apoptózu.
Ureáza
Bakterie využívají produkci ureázy k rozpadu močoviny na amoniak a oxid uhličitý..
Tato akce mu umožňuje udržovat zásadité pH kolem sebe, a tak se vyhnout zničení kyselinou chlorovodíkovou v žaludku, což zaručuje jeho přežití..
Tato vlastnost je kódována genem Ura A..
Vakuování cytotoxinu (VacA)
Je to protein, který vytváří vakuoly v epiteliálních buňkách žaludku, a proto tkáň ulceruje. Je kódován genem VacA.
Cytotoxin (CagA)
Kmeny s genem CagA jsou virulentnější. Ty jsou spojeny s těžkou gastritidou, atrofickou gastritidou, duodenitidou a / nebo rakovinou žaludku.
Tento CagA cytotoxin zvyšuje množení žaludečních buněk bez apoptózy, což vede k modifikaci normální obnovovací struktury žaludečního epitelu..
Superoxiddismutáza a kataláza
Je nezbytný pro ochranu před smrtí závislou na O2 neutrofily.
Funguje tak, že rozkládá peroxid vodíku, metabolit, který je toxický pro bakterie.
Indukovatelná syntáza oxidu dusnatého (iNOS):
Bakterie indukují iNOS a makrofágy in vitro.
Toto zjištění naznačuje, že vysoká produkce oxidu dusnatého v důsledku indukce této syntázy ve spojení s imunitní aktivací se podílí na poškození tkáně..
Fosfolipázy, lipázy a mucinázy
Umožňují invazi mikroorganismu pod žaludeční sliznici a poté upravují hlen tak, aby fungoval jako vodotěsná vrstva, která jej chrání před kyselinou žaludečního světla.
Kromě toho je v tomto místě imunitní odpověď zcela neúčinná..
Taxonomie
Doména: Bakterie
Kmen: Proteobakterie
Třída: Epsilonproteobakterie
Objednat: Campylobacterales
Rodina: Helicobacteraceae
Rod: Helicobacter
Druh: pylori
Morfologie
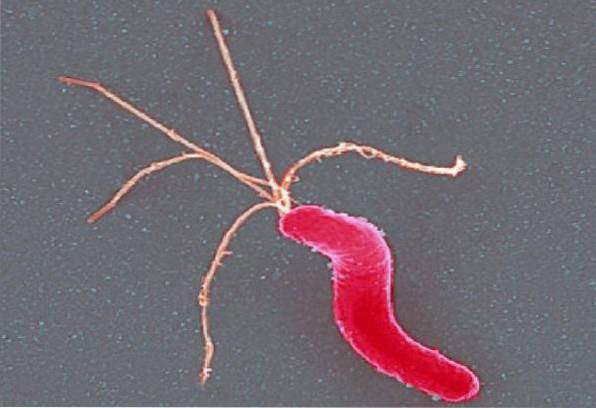
Helicobacter pylori Je to malá, zakřivená, mírně podsaditá, gramnegativní tenká spirálová tyč. Měří přibližně 3 µm dlouhý a 0,5 µm široký. Dobře se barví hematoxylin-eosinem, modifikovaným Giensovým barvením nebo technikou Warthin-Starry.
Je mobilní díky přítomnosti několika polárních bičíků (všívaných), celkem 4 až 6, které jsou charakteristicky opláštěné.
Pouzdro, které pokrývá bičíky, obsahuje proteiny a lipopolysacharid ekvivalentní složkám vnější membrány. Jeho funkce však není známa..
Nevytváří spory a není obalen. Buněčná stěna je podobná jako u jiných gramnegativních bakterií.
Kolonie Helicobacter pylori jsou obvykle malé šedé a průsvitné. Jak kolonie stárnou (prodloužené kultury), bacilární formy se stávají kokcoidními.
Diagnóza
Pro diagnostiku Helicobacter pylori existuje mnoho metod a jsou klasifikovány jako invazivní a neinvazivní.
-Invazivní metody
Biopsie žaludeční sliznice
Je prováděno endoskopií, nejcitlivější metodou pro diagnostiku Helicobacter pylori.
Mikroorganismy lze pozorovat v tkáňových řezech, navíc sliznice bude vykazovat patognomické charakteristiky jejich přítomnosti.
Nevýhodou je, že distribuce H. pylori žaludek není jednotný.
Rychlý test ureázy
Jedná se o metodu nepřímé detekce bakterií.
Části vzorků lze ponořit do močovinového bujónu s indikátorem pH (fenolová červeň) a za méně než hodinu lze pozorovat výsledky.
Močovinové médium se mění ze žluté na fuchsii v důsledku změny pH způsobené produkcí amoniaku z močoviny působením ureázy..
Citlivost tohoto testu závisí na bakteriální zátěži v žaludku..
Kultura vzorků žaludeční sliznice
Část vzorku odebraného endoskopií může být určena ke kultivaci. Negativní kultura je nejcitlivějším indikátorem postterapeutické léčby.
Vzorek biopsie žaludku nebo dvanáctníku musí být čerstvý a jeho transport by neměl trvat déle než 3 hodiny. Mohou být skladovány až 5 hodin při 4 ° C a tkáň musí být udržována vlhká (nádoba s 2 ml sterilního fyziologického solného roztoku).
Před zasetím vzorku je třeba udělat kaši, aby se dosáhlo větší citlivosti. Vzorek lze zasít na agar Brucella, infuzi do mozku nebo sójovou tryptikázu doplněnou 5% ovčí nebo koňské krve.
Polymerázová řetězová reakce (PCR).
Tkáňové řezy mohou být podrobeny technikám molekulární biologie pro detekci DNA mikroorganismu.
Výhodou PCR je, že může být použita při analýze vzorků, jako jsou sliny, což umožňuje diagnostiku H. pylori neinvazivně, i když skutečnost, že bakterie jsou ve slinách, nemusí nutně znamenat infekci žaludku.
-Neinvazivní metody
Sérologie
Tato metoda má citlivost 63-97%. Spočívá v měření protilátek IgA, IgM a IGG pomocí techniky ELISA. Je to dobrá diagnostická možnost, ale má omezenou užitečnost pro monitorování léčby..
Je to proto, že protilátky mohou zůstat zvýšené po dobu až 6 měsíců po odstranění mikroorganismu. Má tu výhodu, že je rychlou, jednoduchou a levnější metodou než ty, které vyžadují biopsii endoskopie..
Je třeba poznamenat, že protilátky generované proti H. pylori, slouží k diagnostice, ale nebrání kolonizaci. Proto lidé, kteří získávají H. pylori mají tendenci trpět chronickými nemocemi.
Dechová zkouška
Pro tento test musí pacient požít uhlíkem značenou močovinu (13C nebo 14C). Když tato sloučenina přijde do kontaktu s ureázou produkovanou bakteriemi, přemění se na značný oxid uhličitý (COdva C14) a amonný (NHdva).
Oxid uhličitý přechází do krve a odtud do plic, kde je vydechován dechem. Vzorek dechu pacienta se shromažďuje v balónu. Pozitivní test potvrzuje infekci touto bakterií.
Upravený dechový test
Je to stejné jako předchozí, ale v tomto případě je přidán koloid 99mTc, který není absorbován v zažívacím systému.
Tento koloid umožňuje vizualizovat produkci močoviny přesně v místě trávicího systému, kde je generována pomocí gama kamery.
Životní cyklus
Helicobacter pylori v těle se chová dvěma způsoby:
98% populace H. pylori bydlí volně v hlenu žaludku. To slouží jako rezervoár pro adherentní bakterie, který bude sloužit k přenosu.
Zatímco 2% jsou připojena k epiteliálním buňkám, které udržují infekci.
Proto existují dvě populace, adherentní a neadherentní, s různými charakteristikami přežití..
Patogeneze
Jakmile bakterie vstoupí do těla, může kolonizovat hlavně žaludeční antrum pomocí faktorů virulence, které má..
Bakterie mohou trvat dlouhou dobu instalované v žaludeční sliznici, někdy po celý život, aniž by způsobovaly nepohodlí. Napadá a kolonizuje hluboké vrstvy hlenu sliznice žaludku a dvanáctníku prostřednictvím proteáz a fosfolipáz.
Poté se připojí k povrchovým epiteliálním buňkám výstelky žaludku a dvanáctníku, aniž by napadl zeď. Jedná se o strategické umístění, které si bakterie osvojují, aby se chránily před extrémně kyselým pH lumen žaludku..
Současně na tomto místě bakterie rozvinou močovinu, aby dále alkalizovaly své prostředí a zůstaly životaschopné..
Většinu času dochází v žaludeční sliznici k nepřetržité zánětlivé reakci, která zase mění mechanismy regulace sekrece žaludeční kyseliny. Takto se aktivují určité ulcerogenní mechanismy, například:
Inhibice funkce parietálních buněk prostřednictvím inhibice somatostatinu, kde je upřednostňována nedostatečná produkce gastrinu.
Produkovaný amoniak plus cytotoxin VacA špatně zacházejí s epiteliálními buňkami, což způsobuje poškození žaludeční nebo duodenální sliznice.
Proto jsou pozorovány degenerativní změny povrchu epitelu, včetně vyčerpání mucinu, cytoplazmatické vakuolizace a dezorganizace hlenových žláz..
Zánětlivý infiltrát
Výše uvedené léze vedou k napadení sliznice a její lamina propria hustým infiltrátem zánětlivých buněk. Zpočátku může být infiltrát minimální pouze s mononukleárními buňkami.
Ale později se zánět může šířit s přítomností neutrofilů a lymfocytů, které způsobují poškození sliznic a parietálních buněk a může dokonce dojít k tvorbě mikroabscesů.
CagA cytotoxin pro svou část vstupuje do buňky epitelu žaludku, kde se spouští více enzymatických reakcí, které způsobují reorganizaci aktinového cytoskeletu.
Specifické mechanismy karcinogeneze nejsou známy. Předpokládá se však, že zánět a agresivita po dlouhou dobu vedou k metaplazii a nakonec k rakovině..
Patologie
Chronická povrchová gastritida obecně vzniká během několika týdnů nebo měsíců po usazení bakterií. Tato gastritida může vést k peptickému vředu a později vést k žaludečnímu lymfomu nebo adenokarcinomu..
Stejně tak infekce Helicobacter pylori je stav, který předisponuje k MALT lymfomu (lymfomu sdruženého s mukosou).
Na druhou stranu to zmiňují nejnovější studie Helicobacter pylori způsobuje extragastrická onemocnění. Patří mezi ně: anémie z nedostatku železa a idiopatická trombocytopenie purpura.
Také kožní onemocnění, jako je růžovka (nejčastější kožní onemocnění spojené s H. pylori), chronické prurigo, chronická idiopatická kopřivka, psoriáza a další. U těhotných žen může způsobit hyperemesis gravidarum.
Další méně časté stránky, o nichž se věří, že jsou H. pylori může mít určitou roli způsobující patologii na úrovni:
Střední ucho, nosní polypy, játra (hepatocelulární karcinom), žlučník, plíce (bronchiektázie a CHOPN chronická obstrukční plicní nemoc).
Bylo také spojeno s očními chorobami (glaukom s otevřeným úhlem), kardiovaskulárními chorobami, autoimunitními poruchami, mimo jiné.
Klinické projevy
Tato patologie může být asymptomatická až u 50% dospělých. Jinak může u primární infekce způsobit nevolnost a bolesti v horní části břicha, které mohou trvat až dva týdny.
Později příznaky zmizí, aby se znovu objevily později po instalaci gastritidy a / nebo peptického vředu.
V tomto případě jsou nejčastějšími příznaky nevolnost, anorexie, zvracení, bolest v nadbřišku a ještě méně specifické příznaky, jako je říhání..
Peptický vřed může způsobit závažné krvácení, které může být komplikováno peritonitidou v důsledku úniku obsahu žaludku do peritoneální dutiny.
Nákaza
Lidé s Helicobacter pylori mohou vylučovat bakterie ve svých výkalech. Tímto způsobem by mohlo dojít ke kontaminaci pitné vody. Proto je nejdůležitější cestou kontaminace jedince fekálně-orální.
Předpokládá se, že to může být ve vodě nebo v některých druzích zeleniny, které se obvykle konzumují syrové, jako je salát a zelí.
Tyto potraviny mohou být kontaminovány zaléváním kontaminovanou vodou. Mikroorganismus však nikdy nebyl izolován z vody..
Další neobvyklá cesta kontaminace je orální-orální, ale v Africe to bylo dokumentováno zvykem některých matek předžvýkat jídlo svých dětí..
Nakonec je možná nákaza iatrogenní cestou. Tato cesta spočívá v kontaminaci pomocí kontaminovaného nebo špatně sterilizovaného materiálu při invazivních postupech, které zahrnují kontakt se žaludeční sliznicí..
Léčba
Helicobacter pylori in vitro je citlivý na různé antibiotika. Mezi nimi: penicilin, některé cefalosporiny, makrolidy, tetracykliny, nitroimidazoly, nitrofurany, chinolony a soli vizmutu.
Jsou však neodmyslitelně rezistentní na blokátory receptorů (cimetidin a ranitidin), polymyxin a trimethoprim..
Mezi nejúspěšnější léčby patří:
- Kombinace léků, včetně 2 antibiotik a 1 inhibitoru protonové pumpy.
- Nejběžněji používanou kombinací antibiotik je klarithromycin + metronidazol nebo klarithromycin + amoxicilin nebo klarithromycin + furazolidon nebo metronidazol + tetracyklin.
- Inhibitorem protonové pumpy může být Omeprazol nebo Esomeprazol.
- Některé terapie mohou také zahrnovat spotřebu solí vizmutu.
Terapie musí být dokončena po dobu nejméně 14 dnů, jak doporučuje FDA. U některých pacientů je však tato terapie obtížně tolerovatelná. U nich se doporučuje kombinovat léčbu s konzumací potravin obsahujících probiotika.
Tyto terapie jsou účinné, avšak v posledních letech došlo k rezistenci Helicobacter pylori metronidazol a klarithromycin.
Mikroorganismus lze vyhubit, je však možná reinfekce. Při druhé léčbě reinfekce se doporučuje použití levofloxacinu..
Reference
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiologická diagnostika. (5. vydání). Argentina, Editorial Panamericana S.A.
- Forbes B, Sahm D, Weissfeld A. Bailey & Scott Mikrobiologická diagnostika. 12 ed. Argentina. Redakční Panamericana S.A; 2009.
- Ryan KJ, Ray C.. Sherris. Mikrobiologie Medical, 6. vydání McGraw-Hill, New York, USA; 2010.
- Cava F a Cobas G. Dvě desetiletí roku Helicobacter pylori. VacciMonitor, 2003; 2 (1): 1–10
- González M, González N. Manuál lékařské mikrobiologie. 2. vydání, Venezuela: Ředitelství médií a publikací University of Carabobo; 2011
- Testerman TL, Morris J. Beyond the žalúdek: aktualizovaný pohled na patogenezi, diagnostiku a léčbu Helicobacter pylori. Svět J Gastroenterol. 2014; 20 (36): 12781-808.
- Safavi M, Sabourian R, Foroumadi A. Léčba infekce Helicobacter pylori: Současné a budoucí poznatky. Svět J Clin případy. 2016; 4 (1): 5-19.



Zatím žádné komentáře