
Historie helia, vlastnosti, struktura, rizika, použití
The hélium je chemický prvek, jehož symbolem je On. Jedná se o první vzácný plyn v periodické tabulce a obvykle se nachází zcela vpravo od něj. Za normálních podmínek je to inertní plyn, protože žádná z jeho několika sloučenin není stabilní; Rovněž se velmi rychle rozpíná a je látkou s nejnižší teplotou varu ze všech.
Na populární úrovni je to dobře známý plyn, protože na nesčetných událostech nebo dětských párty je běžné být svědkem toho, jak balón stoupá, dokud se na obloze neztratí. Co je však opravdu a navždy ztraceno v rozích sluneční soustavy i mimo ni, jsou atomy hélia, které se uvolňují, jakmile balón exploduje nebo vyfoukne..

Ve skutečnosti existují lidé, kteří se z dobrého důvodu domnívají, že heliové balónky představují pro tento plyn nevhodný postup. Naštěstí má důležitější a zajímavější využití díky svým fyzikálním a chemickým vlastnostem, které jej oddělují od ostatních chemických prvků..
Například tekuté hélium je tak chladné, že může zmrazit cokoli, například kovovou slitinu, a přeměnit ho na supravodivý materiál. Stejně tak je to kapalina, která se projevuje nadbytečností a je schopná vylézt po stěnách skleněné nádoby..
Jeho název je způsoben skutečností, že byl identifikován poprvé na Slunci a ne na Zemi. Je to druhý nejhojnější prvek v celém vesmíru a přestože je jeho koncentrace v zemské kůře zanedbatelná, lze jej získat ze zásob zemního plynu a radioaktivních minerálů uranu a thoria..
Zde hélium demonstruje další zvědavý fakt: je to plyn, který je mnohem hojnější v podloží než v atmosféře, kde končí únikem ze Země a jejího gravitačního pole.
Rejstřík článků
- 1 Historie
- 2 Fyzikální a chemické vlastnosti
- 2.1 Vzhled
- 2.2 Atomové číslo (Z)
- 2.3 Molární hmotnost
- 2.4 Teplota tání
- 2.5 Bod varu
- 2.6 Hustota
- 2.7 Trojitý bod
- 2.8 Kritický bod
- 2.9 Fúzní teplo
- 2.10 Odpařovací teplo
- 2.11 Molární tepelná kapacita
- 2.12 Tlak par
- 2.13 Ionizační energie
- 2.14 Rozpustnost
- 2.15 Reaktivita
- 2.16 oxidační číslo
- 3 Struktura a elektronická konfigurace
- 3.1 Dimery
- 3.2 Hélium II
- 3.3 Krystaly
- 4 Kde najít a získat
- 4.1 Kosmos a skály
- 4.2 Vzduch a moře
- 4.3 Zkapalňování a destilace zemního plynu
- 5 izotopů
- 6 Rizika
- 7 použití
- 7.1 Tlakové a odvzdušňovací systémy
- 7.2 Detekce úniku
- 7.3 Nosný plyn
- 7.4 Balónky a vzducholodě
- 7.5 Potápění
- 7.6 Obloukové svary
- 7.7 Supravodiče
- 8 Reference
Příběh
Helium nebylo objeveno na Zemi, ale na Slunci. Ve skutečnosti jeho název pochází z řeckého slova „helios“, což znamená slunce. Samotná existence prvku kontrastovala s periodickou tabulkou Dmitrije Mendělejeva, protože v něm nebylo místo pro nový plyn; to znamená, že do té doby nebylo absolutně nic podezřelého z ušlechtilých plynů.
Název „helium“, v angličtině psaný jako „helium“, končil příponou -ium, která jej označuje jako kov; právě proto, že nelze připustit existenci jiného plynu než kyslíku, vodíku, fluoru, chloru a dusíku.
Tento název pojmenoval anglický astronom Norman Lockyer, který studoval z Anglie to, co pozoroval francouzský astronom Jules Janssen v Indii během zatmění slunce v roce 1868.
Byla to žlutá spektrální čára dosud neznámého prvku. Lockyer tvrdil, že to bylo kvůli přítomnosti nového chemického prvku nalezeného na Slunci.
V roce 1895, téměř o dvacet let později, skotský chemik Sir William Ramsay poznal stejné spektrum od zbytkového plynu, když studoval radioaktivní minerál: cleveit. Takže i na Zemi bylo helium.
Fyzikální a chemické vlastnosti
Vzhled
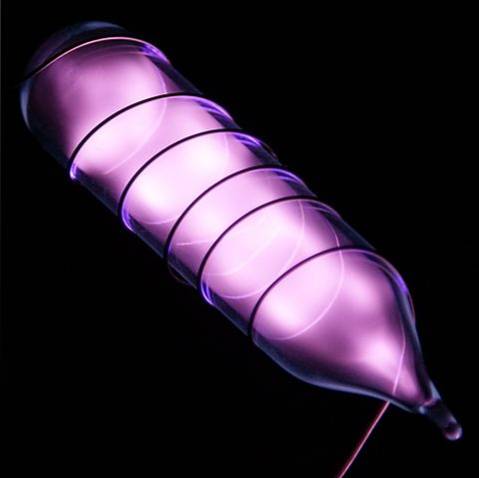
Helium je bezbarvý plyn bez zápachu, který nemá žádnou chuť a je také inertní. Když však dojde k úrazu elektrickým proudem, začne v závislosti na rozdílu napětí zářit jako šedavě fialový opar (obrázek výše), poté zářit oranžově. Proto jsou heliová světla oranžová.
Atomové číslo (Z)
dva
Molární hmotnost
4,002 g / mol
Bod tání
-272,2 ° C
Bod varu
-268,92 ° C
Hustota
-0,1786 g / l, za normálních podmínek, tj. V plynné fázi.
-0,145 g / ml, při teplotě tání, kapalné hélium.
-0,125 g / ml, právě když začne hélium vřít.
-0,187 g / ml, při 0 K a 25 atm, tj. Pevné helium za těchto specifických tlakových a teplotních podmínek.
Trojitý bod
2 177 K a 5 043 kPa (0,04935 atm)
Kritický bod
5,1953 K a 0,22746 MPa (2,2448 atm)
Teplo fúze
0,0138 kJ / mol
Odpařovací teplo
0,0829 kJ / mol
Molární tepelná kapacita
20,78 J / (mol K)
Tlak páry
0,9869 atm při 4,21 K. Tato hodnota vám poskytne představu o tom, jak prchavé hélium může být a jak snadno může uniknout při pokojové teplotě (téměř 298 K).
Ionizační energie
-První: 2372,3 kJ / mol (He+ plynný)
-Za druhé: 5250,5 kJ / mol (Hedva+ plynný)
Ionizační energie pro hélium jsou obzvláště vysoké, protože plynný atom musí ztratit elektron, který zažívá silný efektivní jaderný náboj. Lze to pochopit také tím, že vezmeme v úvahu malou velikost atomu a to, jak „blízké“ jsou dva elektrony k jádru (s jeho dvěma protony a dvěma neutrony).
Rozpustnost
Ve vodě je 0,97 ml rozpuštěno na každých 100 ml vody při teplotě 0 ° C, což znamená, že je špatně rozpustná.
Reaktivita
Helium je druhý nejméně reaktivní chemický prvek v přírodě. Za normálních podmínek je správné říci, že se jedná o inertní plyn; S heliiovou sloučeninou nikdy (jak se zdá) nelze manipulovat v místnosti nebo laboratoři, aniž by na ni působily enormní tlaky; nebo možná dramaticky vysoké nebo nízké teploty.
Příklad vidíme ve sloučenině NadvaTen, který je stabilní pouze pod tlakem 300 GPa, se reprodukoval v buňce diamantové kovadliny.
Zatímco chemické vazby v NadvaJsou „divní“ v tom, že mají své elektrony dobře umístěné v krystalech, zdaleka nejsou jednoduchými Van der Wallsovými interakcemi, a proto se neskladají jednoduše z atomů helia zachycených molekulárními agregáty. Zde vzniká dilema, mezi kterými sloučeninami hélia jsou skutečné a které nikoli..
Například molekuly dusíku při vysokých tlacích mohou zachytit atom helia a vytvořit jakýsi klatrát, He (Ndva)jedenáct.
Podobně existují endohedrální komplexy fullerenových kationtů, C60+n a C.70+n, v jejichž dutinách mohou pojmout atomy helia; a molekulární kation HeH+ (He-H+), nalezený ve velmi vzdálených mlhovinách.
Oxidační číslo
Kdo se ze zvědavosti pokusí vypočítat oxidační číslo pro helium v kterékoli ze svých sloučenin, zjistí, že se rovná 0. V NadvaNapříklad si mohl myslet, že jeho vzorec odpovídá hypotetickým iontům Nadva+mámdva-; ale dalo by se předpokládat, že má čistý iontový charakter, i když ve skutečnosti jeho vazby ani zdaleka nejsou.
Kromě toho helium nezískává elektrony, protože je nedokáže pojmout na 2s oběžné dráze, energeticky nedostupné; Není také možné, aby o ně přišla kvůli malé velikosti svého atomu a velkému efektivnímu jadernému náboji svého jádra. Proto se helium vždy (teoreticky) účastní jako atom He0 ve svých odvozených sloučeninách.
Struktura a elektronická konfigurace
Hélium, stejně jako všechny plyny pozorované na makroúrovni, zabírá objem nádob, ve kterých je uložen, a má tak neurčitý tvar. Když však teplota klesne a začne ochlazovat pod -269 ° C, plyn kondenzuje na bezbarvou kapalinu; helium I, první ze dvou kapalných fází pro tento prvek.
Důvod, proč hélium kondenzuje při tak nízké teplotě, je způsobeno malými rozptylovými silami, které drží jeho atomy pohromadě; bez ohledu na fázi zvažovanou. To lze vysvětlit z jeho elektronické konfigurace:
1 sdva
Ve kterém dva elektrony zabírají atomovou dráhu 1 s. Atom helia lze vizualizovat jako téměř dokonalou sféru, jejíž homogenní elektronická periferie je málo náchylná k polarizaci účinným jaderným nábojem dvou protonů v jádru..
Spontánní a indukované dipólové momenty jsou tedy vzácné a velmi slabé; takže teplota se musí blížit absolutní nule, aby se atomy He přibližovaly dostatečně pomalu a dosáhly toho, aby jejich disperzní síly definovaly kapalinu; nebo ještě lépe, krystal helia.
Dimery
V plynné fázi je prostor, který odděluje atomy He, takový, že lze předpokládat, že jsou vždy od sebe odděleny. A to natolik, že v lahvičce s malým objemem vypadá hélium bezbarvé, dokud není vystaveno elektrickému výboji, který ionizuje své atomy v šedém a nepříliš jasném oparu..
V kapalné fázi však atomy He již nelze „ignorovat“, a to ani při jejich slabých interakcích. Nyní jim disperzní síla umožňuje na okamžik se spojit a vytvořit dimery: He-He nebo Hedva. Hélium tedy lze považovat za obrovské shluky Jehodva v rovnováze s atomy v plynné fázi.
Proto je hélium I tak těžké odlišit od jeho par. Pokud se tato kapalina vylije ze vzduchotěsné nádoby, unikne jako bělavá záře..
Hélium II
Když teplota klesne ještě více a dotkne se 2178 K (-270 972 ° C), nastane fázový přechod: helium I se přemění na helium II.
Od tohoto bodu se z již tak fascinující heliové kapaliny stává tekutina nadměrná nebo kvantová; to znamená, že jejich makroskopické vlastnosti se projevují, jako by dimery Hedva byli to jednotlivé atomy (a možná jsou). Postrádá úplnou viskozitu, protože neexistuje žádný povrch, který by mohl zastavit atom během jeho klouzání nebo „šplhání“.
Proto může helium II stoupat po stěnách skleněné nádoby a překonávat gravitační sílu; bez ohledu na to, jak vysoké jsou, pokud povrch zůstává na stejné teplotě, a proto neprchá.
Z tohoto důvodu nelze tekuté hélium skladovat ve skleněných nádobách, protože by uniklo při sebemenší trhlině nebo mezeře; velmi podobné tomu, jak by se to stalo s benzínem. Místo toho se k navrhování takových nádob používá nerezová ocel (Dewarsovy tanky).
Krystaly
I kdyby teplota klesla na 0 K (absolutní nula), rozptylová síla mezi atomy He by nebyla dostatečně silná, aby je mohla uspořádat do krystalické struktury. Aby došlo k tuhnutí, musí tlak stoupnout na přibližně 25 atm; a poté se objeví kompaktní hexagonální krystaly helia (hcp).
Geofyzikální studie ukazují, že tato struktura hcp zůstává nezměněna bez ohledu na to, jak moc se zvyšuje tlak (až do řádu gigapascalů, GPa). V jejich diagramu tlaku a teploty však existuje úzká oblast, kde tyto krystaly hcp procházejí přechodem na kubickou fázi zaměřenou na tělo (bcc)..
Kde najít a získat
Kosmos a skály

Hélium je druhým nejhojnějším prvkem v celém vesmíru, hned za vodíkem. Hvězdy neustále produkují nezměrné množství atomů helia fúzí dvou vodíkových jader během procesu nukleosyntézy..
Podobně jakýkoli radioaktivní proces, který emituje částice α, je zdrojem produkce atomů helia, pokud interagují s elektrony v prostředí; například s těly skalního těla v ložiskách radioaktivních minerálů uranu a thoria. Tyto dva prvky procházejí radioaktivním rozpadem, počínaje uranem:
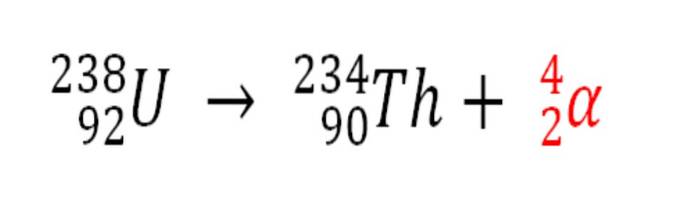
Proto v horninách, kde jsou tyto radioaktivní minerály koncentrovány, budou zachyceny atomy helia, které se uvolní, jakmile budou tráveny v kyselém prostředí..
Mezi některé z těchto minerálů patří cleveit, karnotit a uraninit, všechny složené z oxidů uranu (UOdva nebo U3NEBO8) a nečistoty thoria, těžkých kovů a vzácných zemin. Hélium zavlažované podzemními kanály se může hromadit v zásobnících zemního plynu, minerálních pramenech nebo v meteorických žehličkách.
Odhaduje se, že ročně se v litosféře vyprodukuje hmotnost helia ekvivalentní 3 000 tunám z radioaktivního rozpadu uranu a thoria..
Vzduch a moře
Hélium není ve vodě příliš rozpustné, takže spíše než později skončí vzestupně z hlubin (ať už je jeho původ kdekoli), dokud nepřekročí vrstvy atmosféry a nakonec nedosáhne vesmíru. Jeho atomy jsou tak malé a lehké, že gravitační pole Země je nedokáže udržet v atmosféře..
Vzhledem k výše uvedenému je koncentrace helia jak ve vzduchu (5,2 ppm), tak v mořích (4 ppt) velmi nízká..
Pokud bychom ho chtěli extrahovat z kteréhokoli z těchto dvou médií, „nejlepší“ možností by byl vzduch, který by nejprve musel být podroben zkapalňování, aby kondenzoval všechny jeho složkové plyny, zatímco hélium zůstává v plynném stavu..
Není však praktické získávat hélium ze vzduchu, ale z hornin obohacených o radioaktivní minerály; nebo ještě lépe ze zásob zemního plynu, kde hélium může představovat až 7% jeho celkové hmotnosti.
Zkapalňování a destilace zemního plynu
Místo zkapalňování vzduchu je jednodušší a výnosnější používat zemní plyn, jehož složení hélia je nepochybně mnohem větší. Surovinou par excellence (komerční) pro získání helia je tedy zemní plyn, který lze také podrobit frakční destilaci.
Konečný produkt destilace je zakončen čištěním aktivním uhlím, kterým prochází velmi čisté helium. A nakonec se hélium odděluje od neonů kryogenním procesem, při kterém se používá kapalné hélium..
Izotopy
Hélium se v přírodě vyskytuje převážně jako izotop 4Ten, jehož holé jádro je slavná částice α. Tento atom 4Má dva neutrony a dva protony. V menší míře je izotop 3Ten, který má jen jeden neutron. První je těžší (má vyšší atomovou hmotnost) než druhý.
Tedy izotopový pár 3Mám a 4Jsou to ti, kteří definují měřitelné vlastnosti a to, co chápeme jako helium jako chemický prvek. Protože 3Je lehčí, předpokládá se, že jeho atomy mají vyšší kinetickou energii, a proto potřebují ještě nižší teplotu pro soudržnost v supertekutině.
The 3Je zde na Zemi považován za velmi vzácný druh; na měsíčních půdách je však hojnější (přibližně 2 000krát více). Proto byl Měsíc předmětem možných projektů a příběhů 3Ten, který by mohl být použit jako jaderné palivo pro kosmickou loď budoucnosti.
Z dalších izotopů helia lze uvést následující s jejich příslušnými poločasy: 5Mám (t1/2= 7 610-22 s), 6Mám (t1/2= 0,8 s) a 8Mám (t1/2= 0,119 s).
Rizika
Helium je inertní plyn, a proto se neúčastní žádných reakcí, ke kterým dochází v našem těle..
Jeho atomy prakticky přicházejí a vydechují bez jejich interakcí s biomolekulami, které mají následný účinek; kromě zvuku vyzařovaného z hlasivek, které se stávají vysoko posazenými a mají vyšší frekvenci.
Lidé, kteří vdechují helium z balónu (s mírou), mluví vysokým hlasem, podobně jako veverka (nebo kachna).
Problém je v tom, že pokud vdechne nevhodné množství hélia, riskuje udušení, protože jeho atomy vytlačují molekuly kyslíku; a proto nebudete moci dýchat, dokud nevydechnete všechno to hélium, které zase díky jeho tlaku může roztrhat plicní tkáň nebo způsobit barotrauma.
Byly hlášeny případy lidí, kteří zemřeli vdechováním hélia, kvůli tomu, co bylo právě vysvětleno.
Na druhou stranu, i když nepředstavuje riziko požáru vzhledem k jeho nedostatečné reaktivitě s kyslíkem (nebo jinou látkou), je-li skladován pod vysokým tlakem a uniká, jeho únik může být fyzicky nebezpečný..
Aplikace
Fyzikální a chemické vlastnosti helia z něj dělají nejen speciální plyn, ale také velmi užitečnou látku pro aplikace vyžadující extrémně nízké teploty. V této části se budeme zabývat některými z těchto aplikací nebo použití..
Tlakové a odvzdušňovací systémy
V některých systémech je nutné zvýšit tlak (natlakovat), a proto musí být vstřikován nebo dodáván plyn, který neinteraguje s žádnou z jeho složek; např. s činidly nebo povrchy citlivými na nežádoucí reakce.
Tlak lze tedy zvýšit s objemy hélia, jejichž chemická inertnost je pro tento účel ideální. Inertní atmosféra, kterou podporuje, v určitých případech převyšuje atmosféru dusíku.
Pro reverzní proces, tj. Proplachování, se helium také používá kvůli své schopnosti přenášet veškerý kyslík, vodní páry nebo jakýkoli jiný plyn, jehož přítomnost chcete odstranit. Tímto způsobem se tlak systému sníží, jakmile se hélium vyprázdní..
Detekce úniku
Hélium může prosakovat i při sebemenší prasklině, takže slouží také k detekci úniků v potrubích, vakuových nádobách nebo kryogenních nádržích.
Detekci lze někdy provést vizuálně nebo dotykem; většinou však jde o detektor, který „dává“ signál, kde a kolik helia uniká z kontrolovaného systému..
Nosný plyn
Atomy hélia, jak je uvedeno u čisticích systémů, mohou s sebou nést těžší molekuly, v závislosti na jejich tlaku. Například tento princip se denně používá při analýze plynovou chromatografií, protože může táhnout atomizovaný vzorek podél kolony, kde interaguje se stacionární fází..
Balóny a vzducholodi

Vzhledem ke své nízké hustotě ve srovnání se vzduchem a opět k nedostatečné reaktivitě s kyslíkem se používá na nafukování balónků na dětských párty (ve směsi s kyslíkem, aby se nikdo nedusil dýcháním) a vzducholodí (horní obrázek) bez nebezpečí požáru.
Potápění

Když potápěči sestoupí do větších hloubek, je pro ně obtížné dýchat kvůli velkému tlaku vyvíjenému vodou. Proto se do jejich kyslíkových nádrží přidává hélium, aby se snížila hustota plynu, který potápěči dýchají a vydechují, a proto jej lze vydechovat s menší námahou..
Obloukové svary
V procesu svařování poskytuje elektrický oblouk dostatek tepla pro spojení dvou kovů. Pokud se to provádí v atmosféře helia, žárovkový kov nebude reagovat s kyslíkem ve vzduchu, aby se stal jeho příslušným oxidem; proto helium tomu brání.
Supravodiče
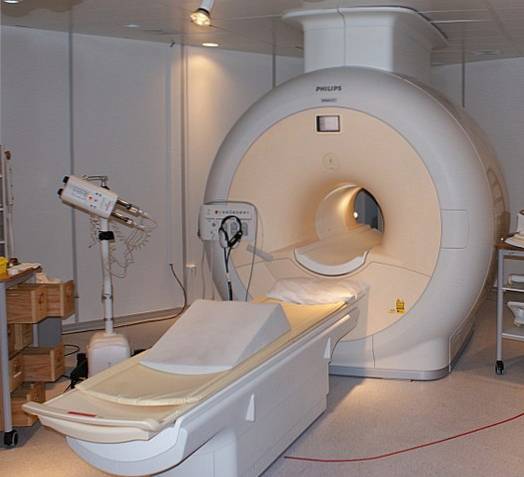
Tekuté hélium je tak chladné, že může zmrazit kovy na supravodiče. Díky tomu bylo možné vyrobit velmi silné magnety, které byly chlazeny kapalným héliem a byly použity v obrazových skenerech nebo spektrometrech nukleární magnetické rezonance..
Reference
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Andy Extance. (17. dubna 2019). Ion hydridu hélia byl poprvé detekován ve vesmíru: byly nalezeny důkazy o nepolapitelné chemii z prvních minut vesmíru. Obnoveno z: chemistryworld.com
- Peter Wothers. (19. srpna 2009). Hélium. Chemie ve svém prvku. Obnoveno z: chemistryworld.com
- Wikipedia. (2019). Hélium. Obnoveno z: en.wikipedia.org
- Mao, H. K., Wu, Y., Jephcoat, A. P., Hemley, R. J., Bell, P. M. a Bassett, W. A. (1988). Krystalová struktura a hustota helia až 232 Kbar. Obnoveno z: articles.adsabs.harvard.edu
- Národní centrum pro biotechnologické informace. (2019). Hélium. Databáze PubChem. CID = 23987. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Mary-Ann Muffoletto. (6. února 2017). Nahoru, nahoru a pryč: Chemici říkají „ano“, helium může tvořit sloučeniny. Státní univerzita v Utahu. Obnoveno z: phys.org
- Steve Gagnon. (s.f.). Izotopy helia prvku. Jefferson Lab. Obnoveno z: education.jlab.org
- Advameg, Inc. (2019). Hélium. Obnoveno z: chemistryexplained.com



Zatím žádné komentáře