
Co je to nasycený roztok? (s příklady)

A nasycený roztok Jedná se o chemický roztok, který obsahuje maximální koncentraci rozpuštěné látky v rozpouštědle. Je považován za stav dynamické rovnováhy, kde jsou rychlosti, při kterých rozpouštědlo rozpouští rozpuštěnou látku, a rychlost rekrystalizace stejné (J., 2014).
Dodatečná rozpuštěná látka se nerozpustí v nasyceném roztoku a objeví se v jiné fázi, ať už jde o sraženinu, pokud jde o pevnou látku v kapalině, nebo o šumění, pokud jde o plyn v kapalině (Anne Marie Helmenstine, 2016).
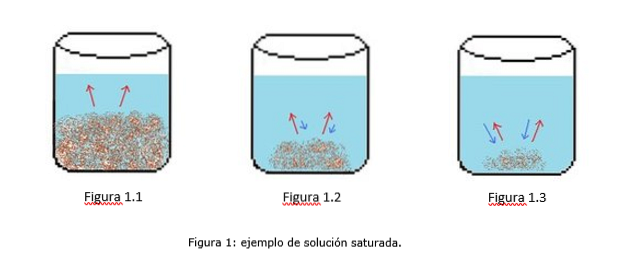
Příklad nasyceného roztoku je znázorněn na obrázku 1. Na obrázcích 1.1, 1.2 a 1.3 je v kádince konstantní objem vody. Na obrázku 1.1 začíná proces nasycení, kdy se rozpuštěná látka začíná rozpouštět, což je znázorněno červenými šipkami.
Na obrázku 1.2 se velká část pevné látky rozpustila, ale ne úplně kvůli rekrystalizačnímu procesu, představovanému modrými šipkami..
Na obrázku 1.3 zůstává nerozpuštěno pouze malé množství rozpuštěné látky. V tomto případě je rychlost rekrystalizace větší než rychlost rozpouštění. (tipy nasycení, 2014)
Bod maximální koncentrace rozpuštěné látky v rozpouštědle je známý jako bod nasycení.
Rejstřík článků
- 1 Faktory ovlivňující sytost
- 1.1 Teplota
- 1.2 Tlak
- 1.3 Chemické složení
- 1.4 Mechanické faktory
- 2 křivky sytosti a rozpustnosti
- 3 Příklady nasycených roztoků
- 4 Co je to přesycené řešení?
- 5 Reference
Faktory ovlivňující sytost
Množství rozpuštěné látky, která může být rozpuštěna v rozpouštědle, bude záviset na různých faktorech, z nichž nejdůležitější jsou:
Teplota
Rozpustnost se zvyšuje s teplotou. Například v horké vodě lze rozpustit více soli než ve studené vodě..
Mohou však existovat výjimky, například rozpustnost plynů ve vodě klesá s rostoucí teplotou. V tomto případě molekuly rozpuštěné látky dostávají při zahřívání kinetickou energii, což usnadňuje jejich únik..
Tlak
Zvýšený tlak může vynutit rozpuštění solutů. To se běžně používá k rozpouštění plynů v kapalinách..
Chemické složení
Rozpustnost ovlivňuje povaha rozpuštěné látky a rozpouštědla a přítomnost dalších chemických sloučenin v roztoku. Například ve vodě lze rozpustit více cukru než soli ve vodě. V tomto případě se říká, že cukr je rozpustnější.
Ethanol ve vodě jsou navzájem zcela rozpustné. V tomto konkrétním případě bude rozpouštědlem sloučenina nalezená v největším množství.
Mechanické faktory
Na rozdíl od rychlosti rozpouštění, která závisí hlavně na teplotě, rychlost rekrystalizace závisí na koncentraci rozpuštěné látky na povrchu krystalové mřížky, která je upřednostňována, když je roztok nepohyblivý.
Proto, míchání roztoku vyhýbá se této akumulaci, maximalizuje rozpuštění (špičky nasycení, 2014).
Křivky sytosti a rozpustnosti
Křivky rozpustnosti jsou grafickou databází, kde se porovnává množství rozpuštěné látky v množství rozpouštědla při určité teplotě.
Křivky rozpustnosti se běžně vykreslují pro množství rozpuštěné látky, ať už pevné nebo plynné, ve 100 gramech vody (Brian, 2014).
Obrázek 2 ilustruje saturační křivky pro různé rozpuštěné látky ve vodě..
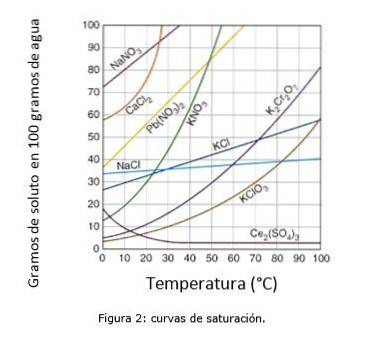
Na ose souřadnic máme teplotu ve stupních Celsia a na ose úsečky máme koncentraci rozpuštěné látky vyjádřenou v gramech rozpuštěné látky na 100 gramů vody.
Křivka ukazuje bod nasycení při dané teplotě. Oblast pod křivkou naznačuje, že máte nenasycené řešení, a proto lze přidat více rozpuštěné látky..
Oblast nad křivkou má přesycené řešení. (Křivky rozpustnosti, n.d.)
Vezmeme-li jako příklad chlorid sodný (NaCl), při 25 stupních Celsia může být přibližně 35 gramů NaCl rozpuštěno ve 100 gramech vody za získání nasyceného roztoku. (Cambrige University, s.f.)
Příklady nasycených roztoků
Nasycené roztoky lze nalézt na každodenní bázi, není nutné být v chemické laboratoři. Rozpouštědlem nemusí být nutně voda. Níže uvádíme každodenní příklady nasycených řešení:
-Soda a nealkoholické nápoje jsou obecně nasycené roztoky oxidu uhličitého ve vodě. Proto se při uvolnění tlaku tvoří bubliny oxidu uhličitého..
-Zeminy jsou nasyceny dusíkem.
-Do octa lze přidat cukr nebo sůl za vzniku nasyceného roztoku..
-Přidejte čokoládu v prášku do mléka, dokud se nerozpustí a nevytvoří nasycený roztok.
-Mléko může být nasyceno moukou do té míry, že do mléka již nelze přidávat mouku.
-Rozpuštěné máslo může být nasyceno solí, když se sůl již nerozpouští.
Co je to přesycené řešení?
Definice přesyceného roztoku je ta, která obsahuje více rozpuštěné rozpuštěné látky, než by se normálně mohlo rozpouštět v rozpouštědle. To se obvykle provádí zvýšením teploty roztoku..
Mírná změna roztoku nebo zavedení „semene“ nebo drobného krystalu rozpuštěné látky vynutí krystalizaci přebytečné rozpuštěné látky. Pokud pro tvorbu krystalů neexistuje žádný nukleační bod, může v roztoku zůstat přebytek rozpuštěné látky.
Jiná forma přesycení může nastat, když je nasycený roztok pečlivě ochlazen. Tato změna podmínek znamená, že koncentrace je ve skutečnosti vyšší než bod nasycení, roztok byl přesycen..
To lze použít v rekrystalizačním procesu k čištění chemikálie: rozpouští se do bodu nasycení v horkém rozpouštědle, poté, co se rozpouštědlo ochladí a rozpustnost klesá, se vysráží nadbytek solutu.
Nečistoty, které jsou přítomny v mnohem nižší koncentraci, nenasycují rozpouštědlo a zůstávají tak rozpuštěné v kapalině.
Reference
- Anne Marie Helmenstine, P. (2016, 7. července). Definice a příklady nasyceného řešení. Citováno z about: about.com
- Cambrige University. (s.f.). Křivky rozpustnosti. Citováno z dynamicscience.com: dynamicscience.com.au.
- Příklady nasyceného řešení. (s.f.). Citováno z yourdcitionary: examples.yourdictionary.com.
- , S. (2014, 4. června). Nasycená a přesycená řešení. Citováno z socratic.org: socratic.org.
- James, N. (s.f.). Nasycené řešení: Definice a příklady. Citováno z study.com: study.com.
- , B. (2014, 14. října). Nasycená a přesycená řešení. Citováno z socratic.org: socratic.org.
- Křivky rozpustnosti. (s.f.). Citováno z KentChemistry: kentchemistry.com.
- Tipy pro sytost. (2014, 26. června). Citováno z chemistry libretex: chem.libretexts.org.



Zatím žádné komentáře