
Popis, struktura a funkce hemidesmosomů
The hemidesmososmas jsou to asymetricky vypadající struktury, které spojují epiteliální buňky. Bazální domény buňky jsou spojeny s podkladovou bazální laminou. Jsou zvláště důležité v tkáních, které jsou ve stálém mechanickém napětí..
Tato epiteliální spojení jsou zodpovědná za zvýšení celkové stability epiteliálních tkání v důsledku účasti intermediálních vláken cytoskeletu a různých složek bazální laminy. To znamená, že podporují stabilní adheze v pojivové tkáni.
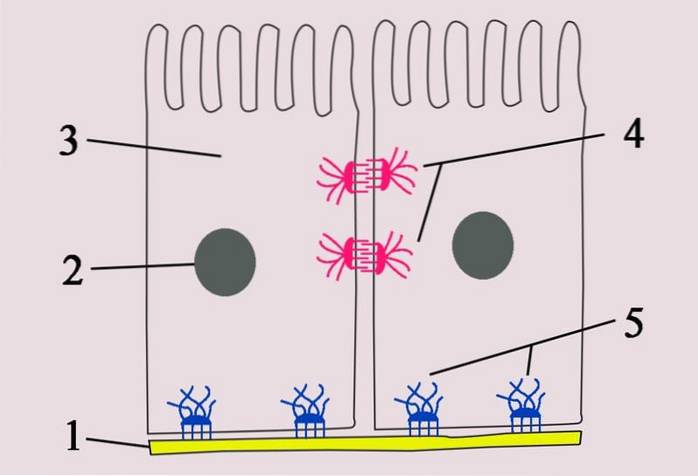
Zdroj možný 2006 [CC BY-SA 4.0 (https://creativecommons.org/licenses/by-sa/4.0)]
Termín hemidesmosom může být zavádějící. I když je pravda, že hemidesmosom připomíná „střední“ desmosom (jiný typ struktury spojené s adhezí mezi sousedními buňkami), málo biochemických složek se shoduje mezi oběma strukturami, takže podobnost je naprosto povrchní.
V klasifikaci buněčných spojů jsou hemidesmosomy považovány za kotevní spojky a jsou seskupeny do těsných spojů, desmosomů pásu a desmosomů bodů.
Kotevní spoje jsou odpovědné za udržování buněk pohromadě, zatímco opačná kategorie (mezery) mají komunikační funkce mezi sousedními buňkami..
Rejstřík článků
- 1 Popis
- 2 Struktura
- 2.1 Proteiny, které tvoří hemidesmosom
- 3 funkce
- 4 Odkazy
Popis
Buňky jsou stavebními kameny živých věcí. Analogie s cihlou nebo konstrukčním blokem však v některých ohledech selhává. Na rozdíl od cihel budovy mají sousední buňky řadu spojení a navzájem komunikují.
Mezi buňkami existují různé struktury, které je spojují a umožňují kontakt i komunikaci. Jednou z těchto kotevních struktur jsou desmosomy.
Hemidesmosomy jsou buněčné spoje nacházející se v různých epitelích a jsou vystaveny stálému oděru a mechanickým silám..
V těchto oblastech existuje potenciální oddělení mezi epiteliálními buňkami od podkladové pojivové tkáně díky mechanickému namáhání. Termín hemidesmosom pochází ze zjevné podobnosti s polovičními desmosomy.
Jsou běžné v kůži, rohovce (struktura umístěná v oku), různých sliznicích ústní dutiny, jícnu a pochvě.
Jsou umístěny na povrchu bazálních buněk a zajišťují zvýšení adheze bazální laminy.
Struktura
Desmosome je asymetrická spojovací struktura, která se skládá ze dvou hlavních částí:
- Vnitřní cytoplazmatická vrstva nalezená ve spojení s intermediárními vlákny - ta jsou také známá jako keratiny nebo tonofilamenty.
- Druhou složkou hemidesmosomů je vnější membránová deska, která je zodpovědná za spojení hemidesmosomu s bazální laminou. V této asociaci se účastní kotevní vlákna (vyrobená z lamininu 5) a integrin..
Proteiny, které tvoří hemidesmosom
V plaku hemidesmosomů jsou následující hlavní proteiny:
Plectin
Plectin je zodpovědný za vytváření příčných vazeb mezi středními vlákny a adhezivní deskou desmosomu.
Ukázalo se, že tento protein má schopnost interagovat s jinými strukturami, jako jsou například mikrotubuly, aktinová vlákna, mimo jiné. Proto jsou klíčové při interakci s cytoskeletem..
BP 230
Jeho funkcí je fixovat mezilehlá vlákna na intracelulární adhezní desku. Jmenuje se 230, protože jeho velikost je 230 kDa.
Protein BP 230 byl spojen s různými nemocemi. Nedostatek správně fungujícího BP 230 způsobuje stav zvaný bulózní pemfigoid, který způsobuje výskyt puchýřů.
U pacientů trpících tímto onemocněním bylo možné detekovat vysokou hladinu protilátek proti složkám hemidesmosomů.
Erbina
Je to protein s molekulovou hmotností 180 kDa. Je zapojen do spojení mezi BP 230 a integriny.
Integrita
Na rozdíl od desmosomů, které jsou bohaté na kadheriny, mají hemidesmosomy vysoké množství typu proteinu zvaného integriny.
Konkrétně najdeme protein integrin α6β4. Jedná se o heterodimer tvořený dvěma polypeptidovými řetězci. Existuje extracelulární doména, která vstupuje do bazální laminy a navazuje interakce s lamininy (laminin 5).
Kotevní vlákna jsou molekuly tvořené lamininem 5, které se nacházejí v extracelulární oblasti hemidesmosomů. Vlákna sahají od molekul integrinu k bazální membráně.
Tato interakce mezi lamininem 5 a výše uvedeným integrinem je zásadní pro tvorbu hemidesmosomu a udržení adheze v epitelu..
Stejně jako BP 230 byla nesprávná funkčnost integrinů spojena s určitými patologiemi. Jedním z nich je bulózní epidermolýza, dědičné onemocnění kůže. Pacienti s tímto onemocněním mají mutace v genu, který kóduje integriny.
Kolagen typu XVII
Jsou to proteiny, které procházejí membránami a mají hmotnost 180 kDa. Vztahují se k expresi a funkci lamininu 5.
Biochemické a lékařské studie tohoto důležitého proteinu objasnily jeho roli v inhibici migrace buněk umístěných v endotelu během procesu angiogeneze (tvorba krevních cév). Kromě toho reguluje pohyby keratinocytů v kůži.
CD151
Jedná se o 32 kDa glykoprotein a hraje nepostradatelnou roli při akumulaci proteinů integrinového receptoru. Tato skutečnost umožňuje usnadnit interakce mezi buňkami a extracelulární matricí..
Je důležité se vyvarovat záměny pojmů kotevní vlákna a kotevní vlákna, protože oba se v buněčné biologii používají poměrně často. Kotevní vlákna jsou vyrobena z lamininu 5 a kolagenu typu XVII.
Naproti tomu kotvící vlákna jsou vyrobena z kolagenu typu VII. Obě struktury mají různé role v buněčné adhezi.
Funkce
Hlavní funkcí hemidesmosomů je připojení buněk k bazální vrstvě. Posledně jmenovaná je tenká vrstva extracelulární matrice, jejímž úkolem je oddělit epiteliální tkáň a buňky. Jak název napovídá, extracelulární matrix není složena z buněk, ale z vnějších molekul bílkovin..
Jednoduššími slovy; hemidesmosomy jsou molekulární struktury, které zajišťují, že naše pokožka drží pohromadě a funguje jako druh šroubů.
Jsou umístěny v oblastech (sliznice, oči, mimo jiné), které jsou neustále pod mechanickým namáháním a jejich přítomnost pomáhá udržovat spojení mezi buňkou a laminou.
Reference
- Freinkel, R. K. a Woodley, D. T. (Eds.). (2001). Biologie kůže. CRC Press.
- Kanitakis, J. (2002). Anatomie, histologie a imunohistochemie normální lidské kůže. Evropský dermatologický časopis, 12(4), 390-401.
- Kierszenbaum, A. L. (2012). Histologie a buněčná biologie. Elsevier Brazílie.
- Ross, M. H. a Pawlina, W. (2006). Histologie. Lippincott Williams & Wilkins.
- Welsch, U., & Sobotta, J. (2008). Histologie. Panamerican Medical Ed..

Zatím žádné komentáře