
Vlastnosti aromatických uhlovodíků, příklady, aplikace

The aromatické uhlovodíky nebo areny jsou sada organických sloučenin, které jsou složeny pouze z uhlíků a vodíků a které se vyznačují tím, že mají v molekulárních strukturách benzenové kruhové jednotky.
Někteří, jak zdůrazňuje jejich název, vydávají sladkou a příjemnou vůni; proto je první organičtí chemici označovali jako aromáty. Například metanový plyn je uhlovodík bez zápachu; zatímco toluen, těkavá kapalina, má docela zvláštní a silný zápach.
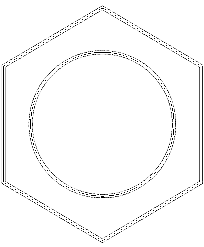
Na obrázku výše máme druh sítě nebo sítě tvořené benzenovými kruhy. Všimněte si jeho šestihranných geometrií a kruhu uvnitř. Tento kruh představuje to, co je známé jako aromaticita, což je zcela chemická a nefyzická vlastnost, nezávislá na pachech těchto uhlovodíků..
Aromatické uhlovodíky patří mezi nejdůležitější látky extrahované nebo vyrobené z ropných a uhlíkových minerálů. Benzen je základním kamenem těchto uhlovodíků a jejich aplikací, protože se získává z nekonečných sloučenin, které se používají jako surovina pro výrobu hnojiv, plastů, lepidel, detergentů, parfémů, léků atd..
Rejstřík článků
- 1 Jak jsou pojmenovány aromatické uhlovodíky??
- 1.1 Jediný benzenový kruh
- 1.2 Více prstenů
- 2 Vlastnosti aromatických uhlovodíků
- 2.1 Aromatičnost
- 2.2 Vysoké poměry C / H
- 2.3 Žluté plameny
- 2.4 Substituční reakce
- 2.5 Vůně
- 3 Příklady aromatických uhlovodíků
- 4 Aplikace / použití
- 4.1 Vlákna a plasty
- 4.2 Epoxidové pryskyřice
- 4.3 Čisticí prostředky
- 4,4 TNT
- 4.5 Kyselina benzoová
- 4.6 Rozpouštědla
- 4.7 Benzín
- 5 Reference
Jak jsou pojmenovány aromatické uhlovodíky??
Jediný benzenový kruh
U aromatických uhlovodíků máme tu zvláštnost, že jejich tradiční nebo běžné názvy mají tendenci převažovat nad těmi, které se řídí nomenklaturou IUPAC.
Všechny obsahují benzenový kruh nebo kruh, který splňuje vlastnosti aromatičnosti. Nejjednodušší lze pojmenovat na základě benzenu a relativních poloh jeho substituentů.
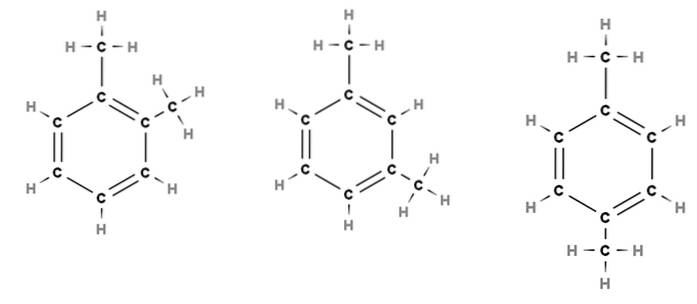
Zvažte například výše uvedený obrázek. Ve třech strukturách vidíme hexagonální kruh benzenu, který má dva methylové substituenty, CH3. Tato sloučenina se tedy nazývá dimethylbenzen, protože se skládá z benzenu se dvěma methyly.
Zleva doprava vidíme, že oddělení obou CH3 stárne, což ovlivňuje nejen fyzikální vlastnosti molekuly, ale také upravuje jejich příslušné názvy. Abychom je mohli odlišit, protože se jim všechny říká dimethylbenzen, používají se předpony ortho (o-), meta (m-) a para (p-).
Proto a znovu, zleva doprava máme: ortho-dimethylbenzen, meta-dimethylbenzen a para-dimethylbenzen. Tradiční název pro tuto sloučeninu je však xylen, takže názvy jsou: ortho-xylen, meta-xylen a para-xylen..
Pokud existují více než dva různé substituenty, jsou uhlíky vyjmenovány podle stejných pravidel nomenklatury jako pro všechny uhlovodíky.
Více kroužků
U aromatických uhlovodíků s více než jedním benzenovým kruhem se tradiční názvy stávají ještě důležitějšími. Je to proto, že systematické názvy, které popisují jejich struktury, jsou těžkopádné a obtížně zapamatovatelné. Zvažte příklad naftalenu:
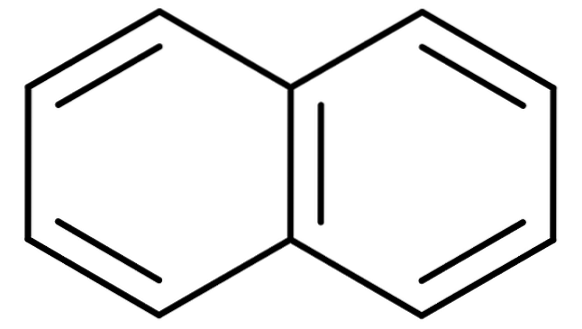
Naftalen je také komerčně známý jako naftalen nebo bílý kafr. Jeho systematický název je však: Bicyklo [4,4,0] deka-1,3,5,7,9 pentaen. A to pouze pro sloučeninu se dvěma kondenzovanými benzenovými kruhy; nomenklatura se stává mnohem komplikovanější pro sloučeniny se třemi nebo více kruhy.
Vlastnosti aromatických uhlovodíků
Aromatičnost
Aromatické uhlovodíky obsahují kruhy, které se řídí Huckelovými pravidly. To znamená, že jejich kruhy musí mít atomy se sp hybridizacídva, být co nejplochější a mít počet delokalizovaných π elektronů rovný 4n + 2. Například benzen je aromatický, protože má 6 delokalizovaných elektronů na n= 1 (4,1 + 2 = 6).
Vysoké poměry C / H
Poměry C / H pro aromatické uhlovodíky jsou vysoké nebo větší než 1. Například pro benzen, C6H6, jeho C / H se rovná 6/6 nebo 1. Zatímco pro naftalen C10H8, jeho C / H se rovná 10/8 nebo 1,25. Co to znamená? Že tyto uhlovodíky jsou ve srovnání s jinými sloučeninami velmi „sycené“.
Žluté plameny
Právě kvůli jejich vysokým poměrům C / H při spalování aromatických uhlovodíků vydávají nažloutlé plameny, produkt vznikajících uhlíkových částic (saze).
Substituční reakce
Aromatické uhlovodíky mohou nahradit své atomy vodíku jakýmkoli jiným substituentem. Toho je dosaženo dvěma typy organických reakcí: elektrofilní aromatickou substitucí (SEAr) nebo nukleofilní aromatickou substitucí (SNAr)..
Vůně
Aromatické uhlovodíky, jak naznačuje jejich název, se vyznačují sladkým nebo silným zápachem. Tato vlastnost je umožňovala v zásadě odlišit od plynných uhlovodíků a některých voskovitých parafinů..
Příklady aromatických uhlovodíků
Aromatické uhlovodíky se, přísně vzato, týkají pouze těch, které jsou složeny z uhlíku a vodíku. Neměly by existovat žádné heteroatomy (O, P, N, S atd.). Následující příklady, které je třeba uvést, proto vynechávají sloučeniny, jako je pyridin, furan nebo fenol..
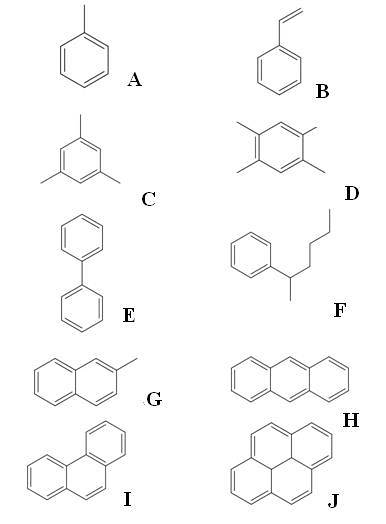
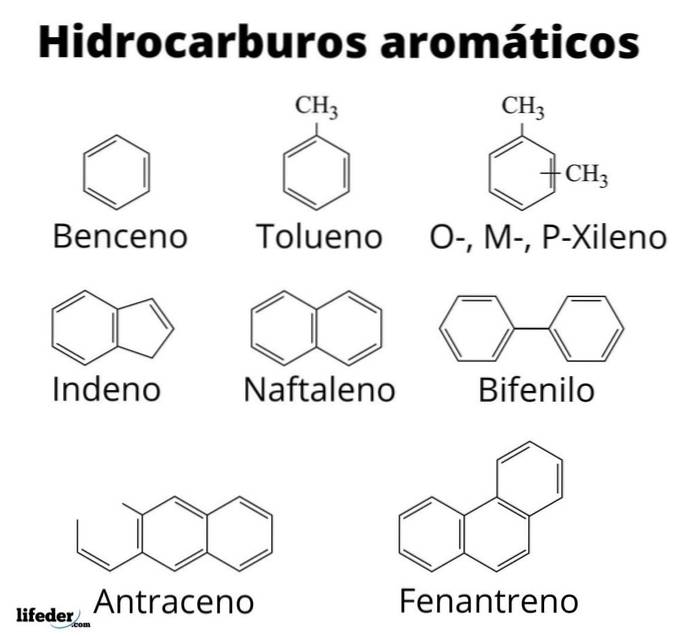
Nahoře máme deset příkladů aromatických uhlovodíků. Všimněte si, že všechny mají alespoň jeden benzenový kruh. Jejich jména jsou:
A: Toluen
B: Styren
C: Mesitylen
D: Dureno
E: Bifenyl
F: 2-fenylhexan
G: 2-Methylnaftalen
H: Anthracen
I: Fenanthren
J: Pyrene
Ze všech je toluen ten s nejvyšší průmyslovou hodnotou.
Aplikace / použití
Většina použití aromatických uhlovodíků spočívá v tom, že slouží jako surovina pro syntézu nebo výrobu produktů s vysokou komerční hodnotou. Téměř všechny vycházejí z benzenu, který je vystaven různým organickým reakcím za účelem získání funkčních derivátů.
Vlákna a plasty
Cyklohexan se vyrábí z benzenu, který se později transformuje na jiné sloučeniny za účelem syntézy nylonu 6 nebo nylonu 66. Na druhé straně styren, který se skládá z monomeru polystyrenu, lze také získat z benzenu. Máme tedy polymery nezbytné pro výrobu vláken a plastů.
Epoxidové pryskyřice
Z benzenu lze rovněž syntetizovat bisfenol A, pomocí kterého se různými syntetickými způsoby vyrábějí epoxidové pryskyřice, lepidla, lepidla a dokonce i barvy..
Čistící prostředky
Alkylbenzeny s dlouhými postranními řetězci se používají k výrobě detergentů; včetně alkylbenzensulfonátů.
TNT
TNT lze vyrobit z toluenu: trinitrotoluenu, jedné z nejznámějších výbušnin.
Kyselina benzoová
Z toluenu se získává kyselina benzoová jako derivát, základní sloučenina pro složení mnoha parfémů, léků a potravin..
Rozpouštědla
Benzen, toluen a xylen (BTX) jsou nejběžněji používanými organickými rozpouštědly ve výzkumu ropy.
Benzín
Aromatické uhlovodíky jsou také součástí složení benzinu a mají hlavní roli při zvyšování jeho oktanového čísla nebo oktanového čísla..
Reference
- Graham Solomons T.W., Craig B.Fryhle. (2011). Organická chemie. (10th edice.). Wiley plus.
- Carey F. (2008). Organická chemie. (Šesté vydání). Mc Graw Hill.
- Morrison a Boyd. (1987). Organická chemie. (Páté vydání). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Aromatická sloučenina. Obnoveno z: en.wikipedia.org
- Ed Vitz a kol. (8. září 2020). Aromatické uhlovodíky. Chemistry LibreTexts. Obnoveno z: chem.libretexts.org
- Wyman Elizabeth. (2020). Aromatické uhlovodíky: definice, příklady a použití. Studie. Obnoveno z: study.com
- Boluda, C. J., Macías, M., & González Marrero, J. (2019). Chemická složitost automobilových benzínů. Věda, technika a aplikace,dva(2), 51-79. Doi: doi.org/10.22206/cyap.2019.v2i2.pp51-79



Zatím žádné komentáře