
Vlastnosti, reaktivita a použití hydridu vápenatého (CaH2)

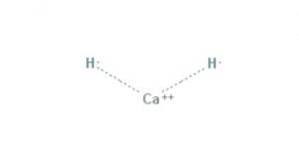
The hydrid vápenatý Jedná se o chemickou sloučeninu vzorce CaH2, která z ní činí hydrid alkalických zemin. Tato chemická sloučenina má dvě iontové vazby mezi vápníkem a dvěma hydridovými ionty, jak je znázorněno na obrázku 1.
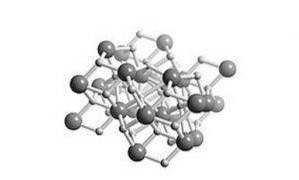
Jedná se o fyziologický roztok, což znamená, že jeho struktura je podobná soli. Jeho krystalická struktura je stejná jako u chloridu olovnatého (minerál kotunnit), jak je znázorněno na obrázku 2.
Všechny alkalické kovy a kovy alkalických zemin tvoří hydridové soli. V chemii je hydridem anion vodíku, H- nebo, častěji, je to sloučenina, ve které jedno nebo více vodíkových center má nukleofilní, redukční nebo bazické vlastnosti.
Ve sloučeninách, které jsou považovány za hydridy, je atom vodíku připojen k více elektropozitivnímu prvku nebo skupině.
Může být vyroben reakcí vápníku a vodíku při teplotě mezi 300 a 400 stupni Celsia. Dalším způsobem, jak připravit hydrid vápenatý, je zahřát chlorid vápenatý společně s vodíkem a kovovým sodíkem. Reakce probíhá následovně:
CaCl2 + H2 + 2Na → CaH2 + 2NaCl
V této reakci vápník (Ca) a vodík (H) vytvářejí molekulu hydridu vápenatého, zatímco atomy sodíku společně s chlorem vytvářejí molekuly chloridu sodného (NaCl)..
Hydrid vápenatý lze také vyrobit redukcí oxidu vápenatého (CaO) hořčíkem (Mg). Reakce se provádí v přítomnosti vodíku. Tato reakce také produkuje oxid hořečnatý (MgO). Níže je uveden vzorec pro tuto chemickou reakci:
CaO + Mg + H2 → CaH2 + MgO
Rejstřík článků
- 1 Fyzikální a chemické vlastnosti hydridu vápenatého
- 2 Reaktivita a nebezpečí
- 3 Zacházení a skladování
- 4 Použití a aplikace
- 4.1 Vysoušedlo
- 4.2 Výroba vodíku
- 4.3 Redukční činidlo
- 5 Nevýhoda při používání hydridu vápenatého
- 6 Reference
Fyzikální a chemické vlastnosti hydridu vápenatého
Hydrid vápenatý je sada krystalů s čistě ortorombickou strukturou bílé barvy. Obecně je vzácné ji najít v této podobě, takže má obvykle šedivý odstín. Postrádá charakteristický zápach. Jeho vzhled je znázorněn na obrázku 3 (Royal Society of Chemistry, 2015).

Má molekulovou hmotnost 42,094 g / mol, bod tání 816 stupňů Celsia a hustotu 1,70 g / ml. Pokud se rozpustí ve vodě, reaguje prudce za vzniku vodíku. Reaguje také s alkoholem (National Center for Biotechnology Information., S.F.).
Reaktivita a nebezpečí
Hydrid vápenatý je stabilní chemická látka, i když je vysoce reaktivní na vodu nebo vlhkost. Při kontaktu s vodou uvolňuje hořlavé vodíkové plyny, které se mohou samovolně vznítit.
Je považována za výbušnou sloučeninu. Při zahřátí v reakci s tetrahydrofuranem může dojít k výbuchu. Při smíchání s chlorečnanem, chlornanem, bromičnanem, chloristanem draselným se stává citlivým na teplo, tření a stává se výbušným (Calcium Hydride 7789-78-8, 2016).
Když se fluorid stříbrný rozdrtí hydridem vápenatým, hmota se stane žárovkou. Silné zahřátí hydridu chlorem, bromem nebo jodem vede k žhavení.
Směsi hydridu s různými bromičnany, například bromičnanem barnatým nebo chlorečnany, například chlorečnanem barnatým a chloristany, jako je chloristan draselný, při mletí explodují. CaH2 reaguje žhavě s fluoridem stříbrným, pokud je vystaven tření.
S touto sloučeninou musí být zacházeno v inertní atmosféře. Pokud se s ním nebude zacházet správně, může to představovat vážnou hrozbu pro zdraví a bezpečnost pracovníků laboratoře, pracovníků první pomoci a osob manipulujících s chemickým odpadem (UC centrum pro laboratorní bezpečnost, 2013).
Extrémně nebezpečný v případě kontaktu s pokožkou nebo očima, protože je dráždivý. Velmi nebezpečné v případě kontaktu s pokožkou, protože může být korozivní.
Nebezpečný je také v případě požití a vdechnutí. Velikost poškození tkáně závisí na délce kontaktu. Kontakt s očima může mít za následek poškození rohovky nebo slepotu..
Kontakt s pokožkou může způsobit zánět a puchýře. Vdechování prachu způsobí podráždění gastrointestinálního nebo dýchacího traktu, které je charakterizováno spálením, kýcháním a kašláním..
Silné nadměrné vystavení může vést k poškození plic, udušení, bezvědomí nebo dokonce smrti. Zánět oka je charakterizován zarudnutím, slzením a svěděním. Zánět kůže je charakterizován svěděním, olupováním, zarudnutím nebo občasnými puchýři.
Opakovaná nízká expozice očí může způsobit podráždění očí. Opakovaná expozice kůže může způsobit místní destrukci kůže nebo dermatitidu..
Opakované vdechování prachu může způsobit různé stupně podráždění dýchacích cest nebo poškození plic. Opakované nebo dlouhodobé vdechování prachu může způsobit chronické podráždění dýchacích cest (bezpečnostní list materiálu, hydrid vápenatý MSDS, 2005)..
V případě kontaktu s očima je třeba je po dobu nejméně 15 minut okamžitě vypláchnout velkým množstvím vody, občas nadzvednout horní a dolní víčko..
V případě kontaktu s pokožkou okamžitě opláchněte velkým množstvím vody po dobu nejméně 15 minut a odstraňte kontaminovaný oděv a obuv..
V případě požití by nemělo být vyvoláno zvracení. Mělo by být zavoláno toxikologické centrum. Doporučuje se opustit místo expozice a okamžitě se pohybovat na čerstvém vzduchu.
V případě vdechnutí je při obtížném dýchání nutné dodat kyslík. Pokud oběť polkla nebo vdechla látku, neměla by se provádět resuscitace z úst do úst..
Umělé dýchání by mělo být vyvoláváno pomocí kapesní masky vybavené jednosměrným ventilem nebo jiným vhodným dýchacím lékařským zařízením. Ve všech případech je nutné okamžitě vyhledat lékařskou pomoc..
Manipulace a skladování
Sloučenina by měla být skladována v suché nádobě mimo dosah tepla. Mělo by být udržováno mimo dosah zdrojů vznícení. Prach by se neměl dýchat. Do tohoto produktu by se neměla přidávat voda
V případě nedostatečného větrání používejte vhodné respirační vybavení, jako je filtrační maska. V případě expozice vyhledejte lékařskou pomoc a pokud možno vystavte štítek. Zabraňte kontaktu s pokožkou a očima.
Hořlavé materiály by obecně měly být skladovány v samostatném bezpečnostním šatníku nebo skladovací místnosti. Uchovávejte obal těsně uzavřený.
Uchovávejte na chladném a dobře větraném místě. Veškeré zařízení obsahující materiál musí být uzemněno, aby se zabránilo elektrickým jiskrám. Nádoba by měla být udržována v suchu a na chladném místě.
Je to nehořlavý materiál. Při hašení požáru kolem této chemické sloučeniny by však hasiči měli nosit vhodné vybavení..
Nikdy se nedoporučuje hasit požár kolem hydridu vápenatého vodou. K tomuto účelu lze použít suchý písek a také sloučeniny jako chlorid sodný a uhličitan sodný..
Aby se odstranil odpadní hydrid vápenatý, musí se rozložit přidáním 25 ml methanolu na každý gram hydridu v atmosféře dusíku za míchání..
Jakmile je reakce dokončena, přidá se stejné množství vody do vodné sloučeniny methoxidu vápenatého a ta se zlikviduje v odtoku velkým množstvím vody (národní výzkumná rada, 1995)..
Použití a aplikace
Vysoušedlo
Hydrid draselný je relativně mírné vysoušedlo. Z tohoto důvodu je použití této sloučeniny jako vysoušedla bezpečnější ve srovnání s reaktivnějšími činidly, jako jsou sodík-draslík a kovové slitiny sodíku. Reaguje s vodou následovně:
CaH2 + 2 H2O → Ca (OH) 2 + 2 H2
Produkty hydrolýzy této reakce, vodík (plyn) a Ca (OH) 2 (vodná směs), lze oddělit od chemického rozpouštědla pomocí procesu filtrace, destilace nebo dekantace..
Tato chemická sloučenina je účinným vysoušedlem pro mnoho bazických rozpouštědel, jako jsou aminy a pyridin. Někdy se používá k předsušení rozpouštědel před použitím reaktivnějších vysoušedel.
Výroba vodíku
Ve 40. letech byla tato sloučenina dostupná jako zdroj vodíku pod obchodním názvem „Hydrolith“..
Jako zdroj vodíku se používá již dlouhou dobu. Stále se používá k výrobě čistého vodíku v laboratořích pro různé experimenty, pokročilé palivové články a bateriové aplikace (American Elements, S.F.).
Sloučenina byla po celá desetiletí široce používána jako bezpečný a pohodlný prostředek k nafukování meteorologických balónů..
Pravidelně se také používá v laboratořích k výrobě malého množství vysoce čistého vodíku pro experimenty. Obsah vlhkosti v motorové naftě se počítá z vodíku vyvinutého po zpracování CaH2.
Redukční prostředek
Při zahřátí na 600 až 1 000 stupňů Celsia lze oxid zirkoničitý, niob, uran, chrom, titan, vanad a tantal snížit na přípravu prášku těchto kovů, takže hydrid vápenatý lze použít při metalurgii prachu.
Následující reakce ilustruje, jak hydrid vápenatý působí jako redukční činidlo:
TiO + 2CaH2 → CaO + H2 + Ti
Nevýhoda při použití hydridu vápenatého
Tato chemická sloučenina je často preferovanou volbou jako sušicí činidlo; Má však také některé nevýhody:
-Účinek sušení této sloučeniny je pomalý, protože není rozpustný v žádném rozpouštědle, se kterým nereaguje násilně..
-Tato prášková sloučenina je nekompatibilní s mnoha rozpouštědly. Jeho reakce s chlorovanými uhlovodíky může dokonce způsobit výbuchy.
-Nelze jej použít k deoxygenaci rozpouštědel, protože není schopen odstraňovat rozpuštěný kyslík.
-Rozlišování mezi hydridem vápenatým a hydroxidem vápenatým je vzhledem k jejich podobnému vzhledu poměrně obtížné.
Reference
- Americké prvky. (S.F.). hydrid vápenatý. Citováno z americanelements.com: americanelements.com.
- Hydrid vápenatý 7789-78-8. (2016). Obnoveno z chemicalbook.com: chemicalbook.com.
- hydrid vápenatý. (s.f.). Citováno od studenta chemie: chemistrylearner.com.
- Bezpečnostní list materiálu Hydrid vápenatý MSDS. (2005, 10. října). Citováno z sciencelab.com: sciencelab.com.
- Národní centrum pro biotechnologické informace. (S.F.). Složená databáze PubChem; CID = 105052. Citováno z pubchem.ncbi.nlm.nih.gov: pubchem.ncbi.nlm.nih.gov.
- národní rada pro výzkum. (devatenáct devadesát pět). Obezřetné postupy v laboratoři: Zacházení s chemickými látkami a jejich likvidace. Washinton: NationalAacademy Press.
- Royal Society of Chemistry. (2015). hydrid vápenatý ID 94784. Citováno z chemspider.com: chemspider.com.
- UC centrum pro laboratorní bezpečnost. (2013, 18. ledna). standardní pracovní postup hydrid vápenatý. Citováno z chemengr.ucsb.edu: chemengr.ucsb.edu.



Zatím žádné komentáře