
Vlastnosti, rizika a použití hydroxidu barnatého (Ba (OH) 2)
The hydroxid barnatý je chemická sloučenina vzorce Ba (OH)dva(HdvaNEBO)X. Je to silná báze a může být v bezvodé, monohydrátové nebo oktohydrátové formě. Monohydrátová forma, nazývaná také barytová voda, je nejběžnější a komerčně používaná. Struktura bezvodých a monohydrátových sloučenin je uvedena na obrázku 1.
Hydroxid barnatý lze připravit rozpuštěním oxidu barnatého (BaO) ve vodě: BaO + 9HdvaO → Ba (OH)dva8HdvaO. Krystalizuje jako oktahydrát, který se při zahřátí na vzduchu stává monohydrátem. Při 100 ° C ve vakuu bude monohydrát produkovat BaO a vodu.
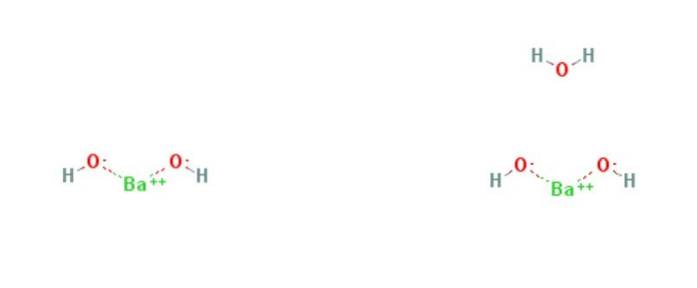
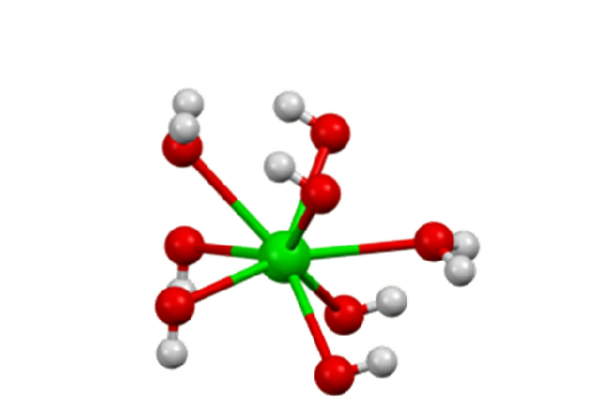
Monohydrát má vrstvenou strukturu (obrázek 2). Ba centradva+ přijímají oktaedrickou geometrii. Každé centrum Badva+ je vázán dvěma vodními ligandy a šesti hydroxidovými ligandy, které jsou dvojitě a trojně přemostěny k Ba centrůmdva+ sousedé.
V oktahydrátu se Ba vycentrujedva+ Jednotlivci jsou opět osm souřadnic, ale nesdílejí ligandy (Barium Hydroxide, S.F.).
Rejstřík článků
- 1 Vlastnosti hydroxidu barnatého
- 2 Reaktivita a nebezpečí
- 2.1 Oční kontakt
- 2.2 Kontakt s pokožkou
- 2.3 Vdechnutí
- 2.4 Požití
- 3 použití
- 3.1 1- Průmysl
- 3.2 2- Laboratoř
- 3.3 3- Katalyzátor ve Wittig-Hornerově reakci
- 3.4 4- Další použití
- 4 Odkazy
Vlastnosti hydroxidu barnatého
Hydroxid barnatý jsou bílé nebo průhledné oktaedrické krystaly. Bez zápachu a s žíravou chutí (National Center for Biotechnology Information., 2017). Jeho vzhled je znázorněn na obrázku 3 (IndiaMART InterMESH Ltd., S.F.).

Bezvodá forma má molekulovou hmotnost 171,34 g / mol, hustotu 2,18 g / ml, teplotu tání 407 ° C a teplotu varu 780 ° C (Royal Society of Chemistry, 2015).
Forma monohydrátu má molekulovou hmotnost 189,355 g / mol, hustotu 3,743 g / ml a teplotu tání 300 ° C (Royal Society of Chemistry, 2015).
Forma oktohydrátu má molekulovou hmotnost 315,46 g / mol, hustotu 2,18 g / ml a teplotu tání 78 ° C (Royal Society of Chemistry, 2015).
Sloučenina je málo rozpustná ve vodě a nerozpustná v acetonu. Je to silná báze s pKa 0,15 a 0,64 pro první a druhý OH- resp.
Hydroxid barnatý reaguje podobně jako hydroxid sodný (NaOH), ale je méně rozpustný ve vodě. Neutralizuje kyseliny exotermicky za vzniku solí a vody. Může reagovat s hliníkem a zinkem za vzniku oxidů nebo hydroxidů kovů a generovat plynný vodík.
Může iniciovat polymerační reakce v polymerovatelných organických sloučeninách, zejména epoxidech.
Může vytvářet hořlavé a / nebo toxické plyny s amonnými solemi, nitridy, halogenovanými organickými sloučeninami, různými kovy, peroxidy a hydroperoxidy. Směsi s chlorovanými gumami explodují při zahřátí nebo rozdrcení (BARIUM HYDROXIDE MONOHYDRATE, 2016).
Hydroxid barnatý se při zahřátí na 800 ° C rozkládá na oxid barnatý. Reakcí s oxidem uhličitým vzniká uhličitan barnatý. Jeho vysoce alkalický vodný roztok prochází neutralizačními reakcemi s kyselinami. Tvoří tedy síran barnatý a fosforečnan barnatý s kyselinou sírovou a fosforečnou..
HdvaSW4 + Ba (OH)dva Baso4 + 2HdvaNEBO
Reakcí se sirovodíkem vznikne sirník barnatý. Srážení mnoha nerozpustných nebo méně rozpustných solí barya může být výsledkem dvojité substituční reakce, když je vodný roztok hydroxidu barnatého smíchán s mnoha roztoky jiných solí kovů..
Smícháním pevného hydratovaného hydroxidu barnatého s pevným chloridem amonným v kádince se vytvoří endotermická reakce za vzniku kapaliny s vývojem amoniaku. Teplota drasticky klesá na přibližně -20 ° C (Royal Society of Chemistry, 2017).
Ba (OH)dva (s) + 2NH4Cl (s) → BaCldva (aq) + 2NH3 (g) + HdvaNEBO

Ba (OH) 2 reaguje s oxidem uhličitým za vzniku uhličitanu barnatého. To je vyjádřeno následující chemickou reakcí:
Ba (OH) 2 + CO2 → BaCO3 + H2O.
Reaktivita a nebezpečí
Hydroxid barnatý je klasifikován jako stabilní nehořlavá sloučenina, která rychle a exotermicky reaguje s kyselinami a je nekompatibilní s oxidem uhličitým a vlhkostí. Sloučenina je toxická a jako silná báze je korozivní.
Vdechnutí, požití nebo kontakt s pokožkou s materiálem může způsobit vážné zranění nebo smrt. Kontakt s roztavenou látkou může způsobit těžké popáleniny kůže a očí..
Je třeba zabránit kontaktu s pokožkou. Účinky kontaktu nebo vdechnutí mohou být opožděné. Oheň může vytvářet dráždivé, žíravé a / nebo toxické plyny. Odpadní voda pro řízení požáru může být korozivní a / nebo toxická a způsobit kontaminaci.
Oční kontakt
Pokud se sloučenina dostane do kontaktu s očima, je třeba kontaktní čočky zkontrolovat a vyjmout. Oči by měly být okamžitě proplachovány velkým množstvím vody po dobu nejméně 15 minut studenou vodou.
Kožní kontakt
V případě kontaktu s pokožkou je třeba postižené místo ihned po dobu nejméně 15 minut opláchnout velkým množstvím vody nebo slabé kyseliny, například octem, a odstranit kontaminovaný oděv a obuv. Podrážděnou pokožku zakryjte změkčovadlem.
Před opětovným použitím vyperte oblečení a obuv. Při silném kontaktu omyjte dezinfekčním mýdlem a znečištěnou pokožku překryjte antibakteriálním krémem..
Inhalace
V případě vdechnutí by měl být postižený přemístěn na chladné místo. Pokud nedýchá, je poskytováno umělé dýchání. Pokud je dýchání obtížné, podejte kyslík.
Požití
Při požití sloučeniny by nemělo být vyvoláno zvracení. Uvolněte těsné oblečení, jako je límeček, opasek nebo kravata.
Ve všech případech by měla být poskytnuta okamžitá lékařská pomoc (Bezpečnostní list materiálu, hydroxid barnatý, monohydrát, 2013).
Aplikace
1 - Průmysl
Průmyslově se hydroxid barnatý používá jako předchůdce jiných sloučenin baria. Monohydrát se používá k dehydrataci a odstranění síranu z různých produktů. Tato aplikace využívá velmi nízkou rozpustnost síranu barnatého. Tato průmyslová aplikace platí také pro laboratorní použití.
Hydroxid barnatý se používá jako přísada do termoplastů (jako jsou fenolové pryskyřice), škrábanců a stabilizátorů PVC ke zlepšení vlastností plastů. Tento materiál se používá jako univerzální přísada do maziv a tuků..
Mezi další průmyslové aplikace hydroxidu barnatého patří výroba cukru, výroba mýdel, zmýdelňování tuků, tavení křemičitanu a chemická syntéza dalších sloučenin baria a organických sloučenin (BARIUM HYDROXIDE, S.F.).
2 - Laboratoř
Hydroxid barnatý se používá v analytické chemii pro titraci slabých kyselin, zejména organických kyselin. Je zaručeno, že jeho čirý vodný roztok neobsahuje uhličitany, na rozdíl od hydroxidu sodného a hydroxidu draselného, protože uhličitan barnatý je nerozpustný ve vodě.
To umožňuje použití indikátorů, jako je fenolftalein nebo thymolftalein (se změnami alkalické barvy), bez rizika chyb při titraci způsobených přítomností uhličitanových iontů, které jsou mnohem méně základní (Mendham, Denney, Barnes, & Thomas, 2000).
Hydroxid barnatý se občas používá v organické syntéze jako silná báze, například pro hydrolýzu esterů a nitrilů:
Hydroxid barnatý se také používá při dekarboxylaci aminokyselin, které v procesu uvolňují uhličitan barnatý..
Používá se také při přípravě cyklopentanonu, diacetalkoholu a gama - laktonu D - gulonic.
3 - Katalyzátor ve Wittig-Hornerově reakci
Wittig-Hornerova reakce, známá také jako Horner-Wadsworth-Emmonsova reakce (nebo HWE reakce), je chemická reakce používaná v organické chemii ke stabilizaci fosfonátových karbaniontů aldehydy (nebo ketony) za vzniku převážně E-alkenů (trans).
Wittig-Hornerova sonkochemická reakce je katalyzována aktivovaným hydroxidem barnatým a probíhá za podmínek rozhraní pevná látka-kapalina..
Soncochemický proces probíhá při teplotě místnosti a s nižší hmotností katalyzátoru a reakční dobou než tepelný proces. Za těchto podmínek se získá výtěžek podobný výtěžku tepelného procesu..
V práci (J. V. Sinisterra, 1987) je analyzován vliv na výkon doby působení ultrazvuku, hmotnost katalyzátoru a rozpouštědla. Aby reakce proběhla, musí se přidat malé množství vody.
Analyzuje se povaha aktivního místa katalyzátoru působícího v procesu. Pro sonochemický proces je navržen mechanismus ETC.
4- Jiná použití
Hydroxid barnatý má další využití. Používá se k mnoha účelům, například:
- Výroba alkálií.
- Skleněná konstrukce.
- Vulkanizace ze syntetického kaučuku.
- Inhibitory koroze.
- Stejně jako vrtné kapaliny, pesticidy a maziva.
- Pro nápravu kotle.
- Zdokonalit rostlinné a živočišné oleje.
- Pro malování freskami.
- Při změkčování vody.
- Jako přísada do homeopatických léků.
- K čištění rozlitých kyselin.
- Používá se také v cukrovarnickém průmyslu k přípravě řepného cukru.
- Konstrukční materiály.
- Elektrické a elektronické výrobky.
- Podlahové krytiny.
Reference
- MONOHYDRÁT HYDROXIDU BARIUM. (2016). Obnoveno z cameochemicals: cameochemicals.noaa.gov.
- Hydroxid barnatý. (S.F.). Obnoveno z chemistrylearner: chemistrylearner.com.
- HYDROXID BARIUM. (S.F.). Obnoveno z chemicalland21: chemicalland21.com.
- IndiaMART InterMESH Ltd… (S.F.). Hydroxid barnatý. Obnoveno z indiamart: dir.indiamart.com.
- V. Sinisterra, A. F. (1987). Ba (OH) 2 jako katalyzátor v organických reakcích. 17. Mezifázová reakce Wittig-Horner tuhá látka-kapalina za sonochemických podmínek. The Journal of Organic Chemistry 52 (17), 3875-3879. researchgate.net.
- Bezpečnostní list materiálu, monohydrát hydroxidu barnatého. (2013, 21. května). Citováno z sciencelab: sciencelab.com/msds.
- Mendham, J., Denney, R. C., Barnes, J. D. a Thomas, M. J. (2000). Vogelova kvantitativní chemická analýza (6. vydání). New York: Prentice Hall.
- Národní centrum pro biotechnologické informace. (2017, 28. března). Složená databáze PubChem; CID = 16211219. Obnoveno z PubChem: pubchem.ncbi.nlm.nih.gov.
- Royal Society of Chemistry. (2015). Hydroxid barnatý. Obnoveno z chemspider: chemspider.com.
- Royal Society of Chemistry. (2015). Hydrát hydroxidu barnatého (1: 2: 1). Obnoveno z chemspider: chemspider.com.
- Royal Society of Chemistry. (2015). Dihydroxybariumhydrát (1: 1). Obnoveno z chemspider: chemspider.com.
- Royal Society of Chemistry. (2017). Endotermické reakce pevné látky. Obnoveno z: learn-chemistry: rsc.org.



Zatím žádné komentáře