
Strukturní hydroxid strontnatý (Sr (OH) ₂), vlastnosti, použití

The hydroxid strontnatý (Sr (OH) ₂) je anorganická chemická sloučenina složená z iontu stroncia (Sr) a dvou hydroxidových iontů (OH). Tato sloučenina se získává kombinací soli stroncia se silnou bází, což vede k alkalické sloučenině, jejíž chemický vzorec je Sr (OH)dva.
Obecně se pro přípravu hydroxidu strontnatého používá jako silná báze hydroxid sodný (NaOH) nebo hydroxid draselný (KOH). Na druhou stranu sůl stroncia (nebo iont stroncia), která reaguje se silnou bází, je dusičnan strontnatý Sr (NO3)dva a proces je popsán následující chemickou reakcí:
2KOH + Sr (č3)dva → 2KNO3 + Sr (OH)dva
V roztoku kation stroncia (Sr+) přichází do styku s hydroxidovým aniontem (OH.)-) tvořící bazickou iontovou sůl stroncia. Vzhledem k tomu, že stroncium je kovem alkalických zemin, je hydroxid strontnatý považován za žíravou alkalickou sloučeninu..
Rejstřík článků
- 1 Získání
- 2 Chemická struktura a fyzikálně-chemické vlastnosti
- 2.1 oktahydrát hydroxidu strontnatého
- 2.2 Monohydrát hydroxidu strontnatého
- 2.3 Bezvodý hydroxid strontnatý
- 2.4 Rozpustnost
- 2.5 Chemická reaktivita
- 3 použití
- 3.1 Těžba melasy a rafinace řepného cukru
- 3.2 Stroncium tuky
- 3.3 Stabilizátor plastů
- 3.4 Další aplikace
- 4 Odkazy
Získávání
Kromě dříve vysvětleného procesu lze říci, že jakmile je reakce provedena, Sr (OH)dva vysráží se z roztoku. Poté se podrobí procesu praní a sušení, až se nakonec získá velmi jemný bílý prášek..
Alternativní metodou pro získání hydroxidu strontnatého je zahřátí uhličitanu strontnatého (SrCO3) nebo síran strontnatý (SrSO4) párou při teplotě mezi 500 ° C a 600 ° C. Chemická reakce probíhá, jak je uvedeno níže:
SrCO3 + HdvaO → Sr (OH)dva + COdva
SrS + 2HdvaO → Sr (OH)dva + HdvaS
Chemická struktura a fyzikálně-chemické vlastnosti
V současné době jsou známy 3 formy hydroxidu strontnatého: oktahydrát, monohydrát a bezvodý.
Oktahydrát hydroxidu strontnatého
Hydroxid strontnatý se vysráží ve formě oktahydrátu z roztoků za normálních podmínek teploty a tlaku (25 ° C a 1 atm), jejichž chemický vzorec je Sr (OH)dva∙ 8HdvaNEBO.
Tato sloučenina má molární hmotnost 265,76 g / mol, hustotu 1,90 g / cm a vysráží se jako tetragonální krystaly (s prostorovou skupinou P4 / ncc) se čtyřúhelníkovým a bezbarvým hranolovým vzhledem..
Podobně má oktahydrát hydroxidu strontnatého schopnost absorbovat vzdušnou vlhkost, protože se jedná o snadno rozvolňující sloučeninu..
Monohydrát hydroxidu strontnatého
Podle studií optické mikroskopie (prováděných pomocí rentgenové difrakční techniky) se zvýšením teploty na přibližně 210 ° C - při konstantním atmosférickém tlaku - Sr (OH)dva∙ 8HdvaNebo je dehydratován a transformován na monohydrát hydroxidu strontnatého (Sr (OH)dva∙ HdvaNEBO).
Tato forma sloučeniny má molární hmotnost 139,65 g / mol a její teplota tání je -73,15 ° C (375 K). Díky své atomové konfiguraci má nižší rozpustnost ve vodě, než je popsáno v oktahydrátové formě..
Bezvodý hydroxid strontnatý
Pokračováním zvyšování teploty systému na asi 480 ° C se dehydratace prodlužuje až do získání bezvodého hydroxidu strontnatého.
Na rozdíl od svých hydratovaných forem má molární hmotnost 121,63 g / mol a hustotu 3,625 g / cm.3. Jeho bodu varu je dosaženo při 710 ° C (1310 ° F nebo 983 K), zatímco teplota tání je při 535 ° C (995 ° F nebo 808 K).
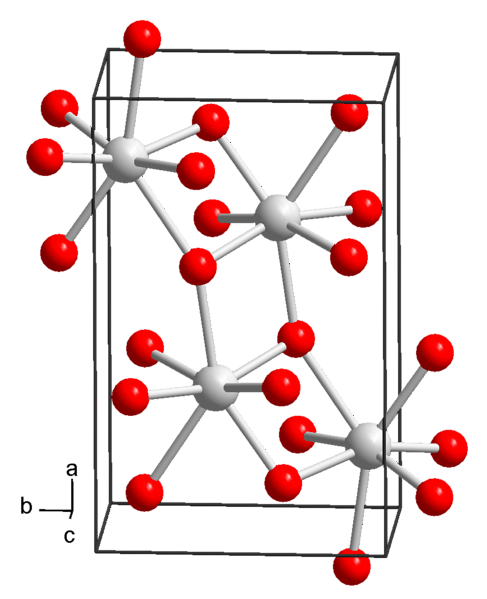
Rozpustnost
Oktahydrát hydroxidu strontnatého má rozpustnost ve vodě 0,91 gramu na 100 mililitrů (měřeno při 0 ° C), zatímco jeho bezvodá forma za podobných teplot má rozpustnost 0,41 gramu na 100 mililitrů.
Podobně je tato látka považována za nerozpustnou v acetonu a plně rozpustnou v kyselinách a chloridu amonném..
Chemická reaktivita
Hydroxid strontnatý není hořlavý, jeho chemická reaktivita zůstává stabilní při mírných teplotách a tlacích a je schopen absorbovat oxid uhličitý z atmosférického vzduchu a přeměňovat ho na uhličitan strontnatý..
Kromě toho jde o silně dráždivou sloučeninu, pokud přijde do styku s pokožkou, dýchacími cestami nebo jinými sliznicemi těla..
Aplikace
Díky svým hygroskopickým vlastnostem a základním vlastnostem se hydroxid strontnatý používá pro různé aplikace v průmyslu:
- Těžba melasy a rafinace cukru z řepy.
- Stabilizátor plastů.
- Tuky a maziva.
Těžba melasy a rafinace řepného cukru
Na začátku 21. století se v Německu začal hydroxid strontnatý používat k rafinaci cukru z řepy postupem patentovaným Carlem Scheiblerem v roce 1882.
Tento postup spočívá ve směsi hydroxidu strontnatého a cukrové řepy řepy, což vede k nerozpustnému disacharidu. Tento roztok se oddělí dekantací a jakmile se provede proces rafinace, získá se cukr jako konečný produkt..
Navzdory skutečnosti, že se tento postup používá dodnes, existují i jiné metody s mnohem větší poptávkou, protože jsou levnější a používají se v drtivé většině cukrovarů na světě. Například metoda Barsil, která používá křemičitan barnatý, nebo metoda Steffen používající Cal jako extrakční činidlo..
Tuky stroncia
Jsou to mazací tuky, které obsahují hydroxid strontnatý. Jsou schopny silně přilnout k povrchům s kovovými vlastnostmi, jsou odolné vůči vodě a odolávají náhlým změnám teploty..
Vzhledem k jejich dobré fyzikální a chemické stabilitě se tato plastická maziva používají jako průmyslová maziva.
Stabilizátor plastů
Převážná většina plastů, když je vystavena klimatickým faktorům, jako je slunce, déšť a atmosférický kyslík, mění své vlastnosti a zhoršuje se.
Vzhledem ke značné odolnosti vůči vodě se k těmto polymerům přidává hydroxid strontnatý - během fáze tání - působící jako stabilizátor při výrobě plastových výrobků, aby se prodloužila jejich životnost..
Další aplikace
- V nátěrovém průmyslu se používá jako základní přísada pro urychlení procesu sušení v komerčních a průmyslových barvách..
- Soli nebo ionty stroncia se získávají z hydroxidu strontnatého, který se používá jako surovina pro výrobu pyrotechnických výrobků..
Reference
- Wikipedia. (n.d.). Hydroxid strontnatý. Obnoveno z en.wikipedia.org
- PubChem. (s.f.). Hydroxid strontnatý. Citováno z pubchem.ncbi.nlm.nih.gov
- Lambert, I. a Clever, H. L. (2013). Hydroxidy alkalických zemin ve vodě a vodných roztocích. Obnoveno z books.google.co.ve
- Krebs, R. E. (2006). Historie a použití chemických prvků naší Země: Referenční příručka. Získané z books.google.co.ve
- Honeywell. (s.f.). Octahydrát hydroxidu strontnatého. Obnoveno z honeywell.com



Zatím žádné komentáře