
Struktura hydroxidu hořečnatého, vlastnosti, názvosloví, použití
The hydroxid hořečnatý je anorganická sloučenina, jejíž chemický vzorec je Mg (OH)dva. Ve své čisté formě je to matná bílá pevná látka s amorfním vzhledem; S malým a přesným obsahem nečistot se však transformuje na krystalický pevný brucit, minerál nacházející se v určitých ložiscích v přírodě, a je bohatým zdrojem hořčíku..
Je to slabý elektrolyt nebo báze, takže jeho disociace je nízká ve vodě. Tato vlastnost činí Mg (OH)dva dobrý neutralizátor kyselosti pro lidskou spotřebu; lék populárně známý jako suspenze magnéziového mléka. Je také retardérem hoření uvolňováním vody během tepelného rozkladu..

Na horním obrázku jsou zobrazeny některé pevné látky hydroxidu hořečnatého, u nichž lze ocenit jeho neprůhlednou bílou barvu. Čím jsou krystaličtější, vytvářejí skelný a perleťový povrch.
Jeho krystalická struktura je zvláštní, protože vytváří dvouvrstvé šestihranné krystaly, které jsou slibným designem pro design nových materiálů. V těchto vrstvách hrají jejich kladné náboje důležitou roli v důsledku substituce Mgdva+ trojmocnými kationty a druhy uzavřené mezi stěnami složenými z OH aniontů-.
Na druhou stranu, další aplikace jsou odvozeny v závislosti na morfologii připravených částic nebo nanočástic; jako katalyzátory nebo adsorbenty. Ve všech z nich je poměr 1: 2 pro ionty Mg udržován konstantní.dva+: ACH-, odráží ve stejném vzorci Mg (OH)dva.
Rejstřík článků
- 1 Struktura
- 1.1 Vzorec a osmistěn
- 1.2 Dvojitá vrstva
- 1.3 Morfologie
- 2 Vlastnosti
- 2.1 Fyzický vzhled
- 2.2 Molární hmotnost
- 2.3 Hustota
- 2.4 Teplota tání
- 2.5 Rozpustnost ve vodě
- 2.6 Index lomu
- 2,7 pH
- 2.8 Tepelná kapacita
- 3 Kde se nachází?
- 4 Názvosloví
- 5 použití
- 5.1 Neutralizátor
- 5.2 Antacida
- 5.3 Zpomalovač hoření
- 5.4 Katalyzátor
- 5.5 Adsorbent
- 6 Reference
Struktura
Vzorec a osmistěn
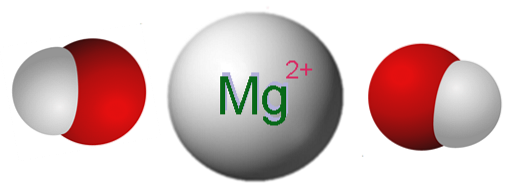
Obrázek výše ukazuje ionty, které tvoří Mg (OH)dva. Jak je vidět, existují dva OH anionty- pro každý Mg kationdva+, které elektrostaticky interagují a definují krystal s hexagonální strukturou. Stejný vzorec naznačuje, že poměr Mg: OH je 1: 2.
Skutečná krystalová struktura je však o něco složitější než za předpokladu jednoduchých iontů Mg.dva+ a OH-. Ve skutečnosti je hořčík charakterizován koordinačním číslem 6, takže může interagovat až se šesti OH-.
Tak se vytvoří oktaedron Mg (OH)6, kde atomy kyslíku evidentně pocházejí z OH-; a krystalová struktura nyní spočívá na zvážení takových oktaedrů a jejich vzájemné interakci.
Ve skutečnosti jsou jednotky Mg (OH)6 nakonec definujeme dvouvrstvé struktury, které jsou zase uspořádány v prostoru, aby vznikl hexagonální krystal.
Dvojitá vrstva
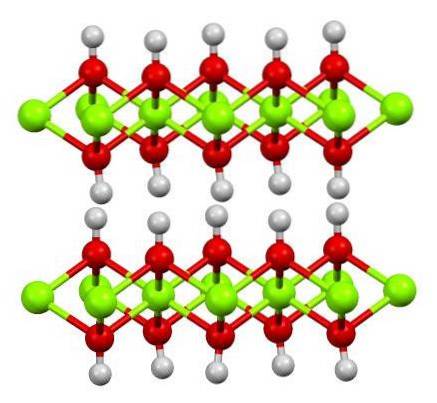
Horní obrázek ukazuje dvouvrstvou strukturu hydroxidu hořečnatého (LDH): Vrstvené dvojité hydroxidy). Zelené koule představují ionty Mgdva+, které by mohly být nahrazeny jinými s vyšším nábojem, aby se vytvořil kladný náboj ve vrstvě.
Všimněte si, že kolem každého Mgdva+ k jejich příslušným bílým koulím je připojeno šest červených koulí; tj. oktaedrické jednotky Mg (OH)6. OH- funguje jako most spojující dva Mgdva+ různých rovin, díky čemuž jsou vrstvy propletené.
Podobně je pozorováno, že atomy vodíku směřují nahoru a dolů a jsou primárně zodpovědné za mezimolekulární síly, které drží dvě vrstvy jednotek Mg (OH) pohromadě.6.
Mezi těmito vrstvami se mohou usazovat neutrální molekuly (jako jsou alkoholy, amoniak a dusík) nebo dokonce anionty, podle toho, jak jsou pozitivní (pokud existují ionty Al3+ o víru3+ nahrazující Mgdva+). „Plnivo“ těchto druhů je omezeno povrchy složenými z OH aniontů-.
Morfologie
Dvouvrstvé šestihranné sklo roste pomalu nebo rychle. Vše závisí na parametrech syntézy nebo přípravy: teplota, molární poměr, míchání, rozpouštědla, činidla jako zdroj hořčíku, zásady nebo srážecí činidla atd. Jak krystal roste, definuje mikrostrukturu nebo morfologii svých nanočástic nebo agregátů.
Tyto nanočástice tedy mohou mít morfologii podobnou květáku, destičkám nebo globule. Stejně tak se může změnit rozložení jejich velikostí, stejně jako stupeň pórovitosti výsledných pevných látek..
Vlastnosti
Fyzický vzhled
Je to bílá, zrnitá nebo prášková pevná látka bez zápachu.
Molární hmotnost
58,3197 g / mol.
Hustota
3,47 g / ml.
Bod tání
350 ° C Při této teplotě se rozkládá na oxid uvolněním molekul vody obsažených v jeho krystalech:
Mg (OH)dva(s) => MgO (s) + HdvaO (g)
Rozpustnost ve vodě
0,004 g / 100 ml při 100 ° C; to znamená, že se sotva rozpouští ve vroucí vodě, což z ní činí nerozpustnou sloučeninu ve vodě. Jak však klesá pH (nebo se zvyšuje kyselost), zvyšuje se jeho rozpustnost v důsledku tvorby komplexního vodného roztoku Mg (OHdva)6.
Na druhou stranu, pokud je Mg (OH)dva absorboval COdva, uvolní zadržený plyn jako šumění, když se rozpustí v kyselém prostředí.
Index lomu
1559
pH
Její vodná suspenze má pH, které se pohybuje mezi 9,5 a 10,5. I když jsou tyto hodnoty normální, odráží jeho nízkou zásaditost ve srovnání s jinými hydroxidy kovů (například NaOH).
Tepelná kapacita
77,03 J / mol K.
Kde se to nachází?

Hydroxid hořečnatý lze v přírodě nalézt jako minerál brucit, který se vyznačuje svou průhlednou bílou barvou se zelenými nebo namodralými tóny v závislosti na jeho nečistotách. Podobně je brucit součástí některých jílů, jako je chloritan, protože je vložen mezi vrstvy křemičitanů spojených kovovými ionty..
V brucitu jsou kromě Mg také další iontydva+, jako Al3+, Víra3+, Zndva+ a Mndva+. Jeho rudy lze nalézt v různých oblastech nebo jezerech Skotska, Kanady, Itálie a USA..
Fyzicky jeho krystaly vypadají jako roztavené sklo (horní obrázek), s bílými, šedavými, namodralými nebo nazelenalými barvami a ve vzácných vzorcích průhledné.
Tento minerál je jedním ze zla, které ovlivňují cementy a beton, protože má tendenci se rozpínat a způsobovat v nich zlomeniny. Neabsorbuje však COdva, takže jeho kalcinace nepřispívá ke skleníkovému efektu, a proto je vhodným mineralogickým zdrojem (a nejbohatším) k získávání hořčíku kromě mořské vody.
Nomenklatura
Mg (OH)dva Má až tři přijatá jména IUPAC (mimo mineralogii nebo medicínu). Jsou si navzájem velmi podobné, protože způsob, jakým skončí, se téměř neliší..
Například „hydroxid hořečnatý“ odpovídá svému názvu podle nomenklatury zásob, na konci je vynechán (II), protože +2 je téměř standardně jediným oxidačním stavem hořčíku.
„Dihydroxid hořečnatý“, označující počet OH iontů s předponou řeckého čitatele- uvedené ve vzorci podle systematické nomenklatury. A „hydroxid hořečnatý“, končící příponou -ico, což je podle tradiční nomenklatury maximální a „jediný“ oxidační stav hořčíku..
Ostatní názvy, například brucit nebo mléčná magnézie, i když přímo souvisejí s touto sloučeninou, není vhodné ji označovat, pokud jde o její nejčistší pevnou látku, nebo jako anorganickou sloučeninu (činidlo, surovina atd.).
Aplikace
Neutralizátor
Mg (OH)dva Za svou nízkou rozpustnost ve vodě vděčí za to, že je vynikajícím neutralizátorem kyselosti; jinak by zalkalizovalo médium poskytnutím velkých koncentrací OH iontů-, stejně jako jiné báze (silné elektrolyty).
Mg (OH)dva sotva uvolňuje OH-, při reakci s ionty H3NEBO+ za vzniku vodného komplexu hořčíku, také zmíněného výše. Je schopen neutralizovat kyselost vodných médií a je určen k čištění odpadních vod.
Je také přísadou do potravin, hnojiv a některých produktů osobní hygieny, jako je zubní pasta, protože snižuje jejich kyselost..
Antacida
Jelikož je slabě rozpustný ve vodě, může být požit bez rizika účinků svých OH iontů- (disociuje velmi málo jako slabý elektrolyt).
Tato vlastnost spojená s podsekcí výše z něj činí antacida k léčbě pálení žáhy, gastrointestinálních onemocnění, zažívacích potíží a zácpy, prodávaných pod vzorcem magnéziového mléka.
Na druhé straně, magnéziové mléko také pomáhá bojovat s otravnými vředy (bílé a červené vředy, které se objevují v ústech).
Zpomalovač ohně
V sekci vlastností bylo uvedeno, že Mg (OH)dva rozkládá uvolňující vodu. Tato voda přesně pomáhá zastavit postup plamenů, protože absorbují teplo, aby se odpařily, a páry zase zředí hořlavé nebo hořlavé plyny.
K tomuto účelu se obvykle průmyslově používá minerál Brucite, určený jako výplň do určitých materiálů, jako jsou plasty různých polymerů (PVC, pryskyřice, pryže), kabely nebo stropy..
Katalyzátor
Mg (OH)dva syntetizováno jako nanočástice, ukázalo se, že je účinné při katalyzování chemických redukcí; například 4-nitrofenol (Ph-NOdva) na 4-aminofenol (Ph-NHdva). Mají také antibakteriální aktivitu, takže by mohly být použity jako terapeutické látky..
Adsorbent
Některé pevné látky Mg (OH)dva mohou být docela porézní, v závislosti na způsobu jejich přípravy. Proto nacházejí uplatnění jako adsorbenty.
Ve vodných roztocích mohou adsorbovat (na svých površích) molekuly barviva a čistit vodu. Například jsou schopné adsorbovat indigokarmínové barvivo přítomné v proudech vody..
Reference
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Wikipedia. (2019). Hydroxid hořečnatý. Obnoveno z: en.wikipedia.org
- Národní centrum pro biotechnologické informace. (2019). Hydroxid hořečnatý. Databáze PubChem. CID = 14791. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Ametystové galerie. (2014). Minerál brucit. Obnoveno z: galleries.com
- Henrist a kol. (2003). Morfologická studie nanočástic hydroxidu hořečnatého
- vysráží ve zředěném vodném roztoku. Journal of Crystal Growth 249, 321-330.
- Saba J., Shanza R. K., Muhammad R. S. (2018). Syntéza a strukturní analýza mezoporézních nanočástic hydroxidu hořečnatého jako účinného katalyzátoru.
- Thimmasandra Narayan Ramesh a Vani Pavagada Sreenivasa. (2015). Odstranění barviva Indigo Carmine z vodného roztoku za použití hydroxidu hořečnatého jako adsorbentu. Journal of Materials, roč. 2015, ID článku 753057, 10 stran. doi.org/10.1155/2015/753057



Zatím žádné komentáře