
Vlastnosti hydroxidu, názvosloví a příklady

The hydroxidy jsou anorganické a ternární sloučeniny, které se skládají z interakce mezi kovovým kationtem a funkční skupinou OH (hydroxidový anion, OH-). Většina z nich má iontovou povahu, i když mohou mít také kovalentní vazby.
Například hydroxid může být reprezentován jako elektrostatická interakce mezi kationtem M.+ a OH anion-, nebo jako kovalentní vazba prostřednictvím vazby M-OH (spodní obrázek). V první dochází k iontové vazbě, zatímco ve druhé kovalentní. Tato skutečnost v podstatě závisí na kovu nebo kationtu M.+, stejně jako jeho náboj a iontový poloměr.
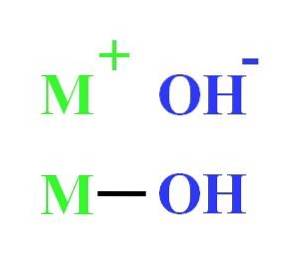
Protože většina z nich pochází z kovů, je ekvivalentní zmínit je jako hydroxidy kovů.
Rejstřík článků
- 1 Jak se tvoří?
- 2 Vlastnosti hydroxidů
- 2,1 OH anion-
- 2.2 Iontový a základní charakter
- 2.3 Periodický trend
- 2.4 Amfoterismus
- 2.5 Struktury
- 2.6 Dehydratační reakce
- 3 Názvosloví
- 3.1 Tradiční
- 3.2 Sklad
- 3.3 Systematika
- 4 Příklady hydroxidů
- 5 Reference
Jak se tvoří?
Existují dvě hlavní syntetické cesty: reakcí odpovídajícího oxidu s vodou nebo se silnou bází v kyselém prostředí:
MO + HdvaO => M (OH)dva
MO + H+ + Ach- => M (OH)dva
Pouze oxidy kovů rozpustné ve vodě reagují přímo za vzniku hydroxidu (první chemická rovnice). Jiné jsou nerozpustné a pro uvolnění M vyžadují kyselé druhy+, který pak interaguje s OH- ze silných bází (druhá chemická rovnice).
Tyto silné báze jsou však hydroxidy kovů NaOH, KOH a další ze skupiny alkalických kovů (LiOH, RbOH, CsOH). Jedná se o iontové sloučeniny vysoce rozpustné ve vodě, a proto jejich OH- se mohou účastnit chemických reakcí.
Na druhou stranu existují hydroxidy kovů, které jsou nerozpustné a v důsledku toho jsou velmi slabými bázemi. Některé z nich jsou dokonce kyselé, jako je tomu v případě kyseliny telurové, Te (OH)6.
Hydroxid vytváří rovnováhu rozpustnosti s okolním rozpouštědlem. Je-li to například voda, pak je rovnováha vyjádřena takto:
M (OH)dva <=> Mdva+(ac) + OH-(ac)
Kde (ac) označuje, že médium je vodné. Když je pevná látka nerozpustná, koncentrace rozpuštěného OH je malá nebo zanedbatelná. Z tohoto důvodu nerozpustné hydroxidy kovů nemohou generovat roztoky tak zásadité jako NaOH..
Z výše uvedeného lze odvodit, že hydroxidy vykazují velmi odlišné vlastnosti spojené s chemickou strukturou a interakcemi mezi kovem a OH. Ačkoli jsou tedy mnohé iontové a mají různé krystalické struktury, jiné mají složité a neuspořádané polymerní struktury..
Vlastnosti hydroxidů
OH anion-
Hydroxylový ion je atom kyslíku kovalentně navázaný na vodík. Lze jej tedy snadno představovat jako OH-. Záporný náboj je umístěn na kyslíku, čímž se tento anion stává druhem elektronového donoru: bází.
Pokud OH- daruje své elektrony vodíku, vytvoří se molekula H.dvaO. Můžete také darovat své elektrony pozitivně nabitým druhům: například kovovým centrům M+. Koordinační komplex je tedy tvořen dativní vazbou M-OH (kyslík poskytuje pár elektronů).
Aby se to však stalo, musí být kyslík schopen efektivně koordinovat s kovem, jinak budou mít interakce mezi M a OH výrazný iontový charakter (M+ Ach-). Protože hydroxylový iont je ve všech hydroxidech stejný, rozdíl mezi nimi spočívá v kationu, který jej doprovází.
Podobně, protože tento kation může pocházet z jakéhokoli kovu na periodické tabulce (skupiny 1, 2, 13, 14, 15, 16 nebo přechodné kovy), vlastnosti takových hydroxidů se nesmírně liší, i když všechny uvažují společně o některých aspektech.
Iontový a základní charakter
V hydroxidech mají sice koordinační vazby, ale latentní iontový charakter. V některých, jako je NaOH, jsou jejich ionty součástí krystalové mřížky tvořené Na kationty+ a OH anionty- v poměru 1: 1; to znamená pro každý iont Na+ existuje OH iont- protějšek.
V závislosti na náboji kovu bude existovat více či méně OH aniontů- kolem toho. Například pro kovový kation Mdva+ tam budou dva OH ionty- interakce s ním: M (OH)dva, co je načrtnuto jako HO- Mdva+ Ach-. Stejným způsobem se to děje s kovy M.3+ as ostatními s kladnějšími náboji (i když jen zřídka překročí 3+).
Tento iontový charakter je zodpovědný za mnoho fyzikálních vlastností, jako jsou teploty tání a teploty varu. Jsou vysoké a odrážejí elektrostatické síly působící v krystalové mřížce. Podobně, když se hydroxidy rozpouštějí nebo tají, mohou vést elektrický proud v důsledku pohyblivosti svých iontů..
Ne všechny hydroxidy však mají stejné krystalové mřížky. U těch nejstabilnějších bude méně pravděpodobné, že se rozpustí v polárních rozpouštědlech, jako je voda. Obecně platí, že čím různorodější jsou iontové poloměry M+ a OH-, rozpustnější bude stejné.
Periodický trend
To vysvětluje, proč se rozpustnost hydroxidů alkalických kovů zvyšuje, když se člověk pohybuje dolů po skupině. Zvyšující se pořadí rozpustností ve vodě je tedy následující: LiOH OH- je malý anion, a jak se kation stává objemnějším, krystalová mřížka energeticky slabne. Na druhou stranu kovy alkalických zemin vytvářejí méně rozpustné hydroxidy díky svým vyšším kladným nábojům. Je to proto, že Mdva+ přitahuje OH silněji- ve srovnání s M.+. Stejně tak jsou jeho kationty menší, a proto s ohledem na OH jsou méně nerovné-. Výsledkem je experimentální důkaz, že NaOH je mnohem bazičtější než Ca (OH).dva. Stejné uvažování lze použít pro jiné hydroxidy, buď pro přechodné kovy, nebo pro hydroxidy p-bloků (Al, Pb, Te atd.). Čím menší a větší je iontový poloměr a kladný náboj M+, čím nižší je iontový charakter hydroxidu, jinými slovy, ty s velmi vysokou hustotou náboje. Příkladem toho je hydroxid berylnatý, Be (OH)dva. On býtdva+ je to velmi malý kation a díky dvojmocnému náboji je elektricky velmi hustý. Hydroxidy M (OH)dva reagovat s kyselinami za vzniku vodného komplexu, tj. M.+ skončí obklopen molekulami vody. Existuje však omezený počet hydroxidů, které mohou také reagovat s bázemi. Jedná se o takzvané amfoterní hydroxidy. Amfoterní hydroxidy reagují s kyselinami i zásadami. Druhá situace může být reprezentována následující chemickou rovnicí: M (OH)dva + Ach- => M (OH)3- Jak ale zjistit, zda je hydroxid amfoterní? Prostřednictvím jednoduchého laboratorního experimentu. Protože mnoho hydroxidů kovů je nerozpustných ve vodě a přidává silnou bázi k roztoku s ionty M.+ rozpuštěný, například Al3+, odpovídající hydroxid se vysráží: Do3+(aq) + 3OH-(ac) => Al (OH)3(s) Ale s přebytkem OH- hydroxid nadále reaguje: Al (OH)3(s) + OH- => Al (OH)4-(ac) Výsledkem je, že nový negativně nabitý komplex je solvatován okolními molekulami vody a rozpouští bílou pevnou látku hydroxidu hlinitého. Hydroxidy, které zůstávají nezměněny s přídavkem báze, se nechovají jako kyseliny, a proto nejsou amfoterní. Hydroxidy mohou mít krystalické struktury podobné strukturám mnoha solí nebo oxidů; některé jednoduché a jiné velmi složité. Navíc ti, u kterých dochází ke snížení iontového charakteru, mohou představovat kovová centra spojená kyslíkovými můstky (HOM-O-MOH). V řešení jsou struktury různé. Ačkoli u vysoce rozpustných hydroxidů stačí je považovat za ionty rozpuštěné ve vodě, u ostatních je třeba vzít v úvahu koordinační chemii. Každý kation M+ lze jej koordinovat s omezeným počtem druhů. Čím je objemnější, tím větší je počet molekul vody nebo OH.- spojené s tím. Odtud pochází slavný koordinační osmistěn mnoha kovů rozpuštěných ve vodě (nebo v jakémkoli jiném rozpouštědle): M (OHdva)6+n, kde n se rovná kladnému náboji kovu. Cr (OH)3, například ve skutečnosti tvoří osmistěn. Jak? S ohledem na sloučeninu jako [Cr (OHdva)3(ACH)3], z nichž tři z molekul vody jsou nahrazeny OH anionty-. Pokud by byly všechny molekuly nahrazeny OH-, pak komplex se záporným nábojem a oktaedrickou strukturou [Cr (OH)6]3-. -3 náboj je výsledkem šesti záporných nábojů OH-. Hydroxidy lze považovat za „hydratované oxidy“. V nich je však „voda“ v přímém kontaktu s M.+; zatímco v hydratovaných oxidech MO nHdvaNebo jsou molekuly vody součástí vnější koordinační sféry (nejsou blízko kovu). Tyto molekuly vody lze extrahovat zahřátím vzorku hydroxidu: M (OH)dva + Q (teplo) => MO + HdvaNEBO MO je oxid kovu vytvořený v důsledku dehydratace hydroxidu. Příkladem této reakce je reakce pozorovaná při dehydrataci hydroxidu měďnatého, Cu (OH)dva: Cu (OH)dva (modrá) + Q => CuO (černá) + HdvaNEBO Jaký je správný způsob zmínky o hydroxidech? IUPAC za tímto účelem navrhl tři nomenklatury: tradiční, skladovou a systematickou. Je správné použít kterýkoli ze tří, nicméně pro některé hydroxidy může být pohodlnější nebo praktičtější zmínit to tak či onak. Tradiční nomenklatura je jednoduše přidat příponu -ico k nejvyšší valenci kovu; a přípona -oso na nejnižší. Například pokud má kov M valence +3 a +1, hydroxid M (OH)3 bude se jmenovat hydroxid (název kovu)ico, zatímco hydroxid MOH (název kovu)medvěd. Chcete-li určit valenci kovu v hydroxidu, podívejte se na číslo za OH v závorkách. M (OH)5 znamená, že kov má náboj nebo valenci +5. Hlavní nevýhodou této nomenklatury však je, že může být komplikovaná pro kovy s více než dvěma oxidačními stavy (jako je chrom a mangan). V takových případech se předpony hyper- a hypo- používají k označení nejvyšší a nejnižší valence.. Pokud tedy M místo toho, aby měl pouze valence +3 a +1, má také +4 a +2, pak jsou názvy jeho hydroxidů s nejvyšší a nejnižší valencí: hydroxid hyper(název kovu)ico, a hydroxid škytavka(název kovu)medvěd. Ze všech nomenklatur je to nejjednodušší. Zde za názvem hydroxidu jednoduše následuje valence kovu uzavřená v závorkách a napsaná římskými číslicemi. Opět pro M (OH)5, například vaše nomenklatura akcií bude: (název kovu) hydroxid (V). (V) označuje pak (+5). Nakonec je systematické názvosloví charakterizováno uchýlením se k násobení předpon (di-, tri-, tetra-, penta-, hexa- atd.). Tyto předpony se používají k určení počtu atomů kovů a iontů OH.-. Tímto způsobem je M (OH)5 pojmenovaný jako: (název kovu) pentahydroxid. V případě Hgdva(ACH)dva, například by to byl dimercuric dihydroxid; jeden z hydroxidů, jejichž chemická struktura je na první pohled složitá. Některé příklady hydroxidů a jejich odpovídající nomenklatury jsou následující: -NaOH (hydroxid sodný) -Ca (OH) 2 (hydroxid vápenatý) -Fe (OH)3. (Hydroxid železitý; hydroxid železitý; nebo trihydroxid železa) -V (OH)5 (Hydroxid pervanaditý; Hydroxid vanaditý; nebo pentahydroxid vanadu). -Sn (OH)4 (Hydroxid křemičitý; hydroxid cínatý; nebo tetrahydroxid cínu). -Ba (OH)dva (Hydroxid barnatý nebo dihydroxid barnatý). -Mn (OH)6 (Hydroxid manganatý, hydroxid manganičitý nebo hexahydroxid manganatý). -AgOH (hydroxid stříbrný, hydroxid stříbrný nebo hydroxid stříbrný). Všimněte si, že pro tuto sloučeninu neexistuje žádný rozdíl mezi základní a systematickou nomenklaturou. -Pb (OH)4 (Hydroxid olovnatý, hydroxid olovnatý nebo tetrahydroxid olovnatý). -LiOP (hydroxid lithný). -Cd (OH) 2 (hydroxid kademnatý) -Ba (OH)dva (Hydroxid barnatý) -Hydroxid chromitýAmfoterismus
Struktury
Dehydratační reakce
Nomenklatura
Tradiční
Skladem
Systematický
Příklady hydroxidů


Reference



Zatím žádné komentáře