
Imunofluorescenční zdůvodnění, protokol a aplikace
The imunofluorescence je účinná technika imunoznačení, která využívá protilátky kovalentně spojené s fluorescenčními molekulami k identifikaci specifických cílů ve vzorcích buněk fixovaných na pevném podkladu.
Tato technika zahrnuje mikroskopické pozorování s imunologickou specificitou, což umožňuje pozorovat živé nebo mrtvé buňky, které mohou představovat nepatrná množství antigenů. Je široce používán jak v oblasti výzkumu, tak v klinické diagnostice různých patologií.
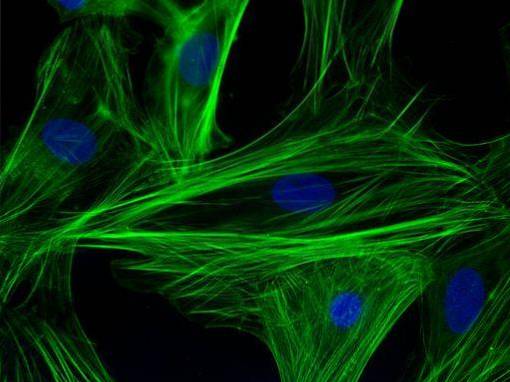
Tato technika, převážně kvalitativní (s některými kvantitativními variantami), má co do činění konkrétně s vizualizací vzorku produktovým signálem fluoroforu, což je fluorescenční molekula vázaná na protilátku a která může být excitována při určité vlnové délce ..
V buněčném kontextu je velmi užitečné studovat přítomnost / nepřítomnost a subcelulární umístění proteinů. Tato technika byla v počátcích používána v klinickém prostředí pro diagnostiku virů, jako je chřipka, a následně pro mnoho dalších infekčních onemocnění..
Jedná se o vysoce citlivou techniku a s příslušným mikroskopickým vybavením může mít velmi dobré rozlišení. K pozorování vyžaduje použití konfokálních nebo epifluorescenčních mikroskopů.
Přesto, že je velmi populární, může představovat některé důležité problémy s ohledem na získání nespecifické fluorescence, která generuje určitý „šum“ v pozadí, který často omezuje adekvátní čtení výsledků..
Rejstřík článků
- 1 Odůvodnění
- 2 Protokol
- 2.1 - Příprava
- 2.2 Oprava vzorků
- 2.3 Permeabilizace
- 2.4 Blokování
- 2.5 Imunologické barvení nebo imunobarvení
- 2.6 Montáž a pozorování
- 3 typy
- 3.1 Přímá nebo primární imunofluorescence
- 3.2 Nepřímá nebo sekundární imunofluorescence
- 4 Aplikace
- 5 Reference
Základ
Imunofluorescence je založena na využití biologického jevu interakční reakce mezi protilátkou a antigenem. Týká se to konkrétně vizualizace nebo detekce této reakce vzrušujícími fluorescenčními molekulami při specifické vlnové délce.
Protilátka je imunoglobulinový protein vylučovaný z aktivních B buněk, který je specificky generován proti antigenu, na který se může vázat s velkou afinitou a specificitou. Imunofluorescence využívá IgG imunoglobuliny, které jsou rozpustné v krevním séru..
Protilátky jsou molekuly do 950 kDa složené ze dvou krátkých (lehkých) a dvou dlouhých „Y“ (těžkých) peptidových řetězců. Lehký i těžký řetězec jsou rozděleny do dvou domén: jedna variabilní, schopná rozpoznávat antigen, a druhá konstantní nebo konzervovaná, charakteristická pro každý druh..
Antigeny jsou funkčně definovány jako molekuly, které lze rozpoznat podle protilátky a jsou to většinou proteiny. Když je zvíře vystaveno antigenu, aktivují se lymfocyty imunitního systému a produkují proti němu specifické protilátky, které fungují jako obranný systém..
Antigen, jako je například protein, může mít více než jeden epitop nebo místo rozpoznání protilátkou, takže sérum zvířete vystaveného antigenu může mít polyklonální protilátky proti různým oblastem stejného proteinu..
Imunofluorescence pak využívá schopnost zvířete produkovat polyklonální protilátky proti specifickému antigenu, aby jej očistil a následně použil pro detekci stejného antigenu v jiných kontextech..
Mezi fluorescenční barviva nebo molekuly nejpoužívanější pro některé imunofluorescenční techniky patří fluorescein isothiokyanát (FITC), tetramethylrhodamin isothiokyanát-5 a 6 (TRITC), mnoho kyaninů jako Cy2, Cy3, Cy5 a Cy7 a barviva zvaná Alexa Fluor®, například Alexa Fluor®448.
Protokol
Imunofluorescenční protokol se liší v závislosti na mnoha faktorech, obecně však zahrnuje lineární posloupnost kroků skládajících se z:
- Příprava sklíček a buněk
- Oprava vzorků
- Permeabilizace
- Blokování
- Imunologické barvení nebo imunobarvení
- Shromáždění a pozorování
-Příprava
Ze vzorků
Příprava vzorků bude záviset na jejich povaze a typu zkušeností, které mají být provedeny. Dále bude vysvětlen nejjednodušší případ, který zahrnuje použití buněk v suspenzi..
Buňky v suspenzi, tj. V kapalném kultivačním médiu, musí být z ní nejprve odděleny centrifugací a poté musí být promyty pufrovacím roztokem nebo "nárazník " isosmotický, zachování jeho integrity.
Normálně se používá fosfát-solný pufr známý jako PBS, ve kterém se buňky resuspendují a tato směs se znovu centrifuguje, aby se získaly buňky bez kultivačního média, které může obsahovat interferující látky..
Čepelí
Sklíčka použitá pro mikroskopické pozorování, kde budou buňky později fixovány pro odpovídající následné ošetření, musí být také pečlivě připravena..
Ty jsou pokryty nebo „senzibilizovány“ roztokem poly-lysinu, syntetického polymeru, který bude působit jako „molekulární lepidlo“ mezi buňkami a pevným podkladem díky elektrostatické interakci mezi kladnými náboji jejich aminoskupin a buňky. negativní náboje na bílkovinách, které obalují buňky.
Oprava vzorků
Tento proces spočívá v imobilizaci proteinů nacházejících se v buňce, aby se zachovalo jejich prostorové umístění beze změny. Použité molekuly musí být schopné procházet všemi typy buněčných membrán a vytvářet mřížky s kovalentními proteiny..
Široce se používá formaldehyd a paraformaldehyd, glutaraldehyd a dokonce i methanol, přičemž se vzorky buněk po určitou dobu inkubují a poté promyjí izosmotickým pufrovacím roztokem.
Po fixaci buněk se pokračují v připojování k fóliím dříve senzibilizovaným polylysinem..
Permeabilizace
V závislosti na typu prováděného testu bude nutné permeabilizovat studované buňky nebo ne. Pokud je hledáno znát umístění, přítomnost nebo nepřítomnost určitého proteinu na buněčném povrchu, permeabilizace nebude nutná.
Na druhou stranu, pokud chcete znát umístění proteinu uvnitř buňky, je permeabilizace nezbytná a bude spočívat v inkubaci vzorků s Triton X-100, detergentem schopným permeabilizace buněčných membrán..
Blokování
Zásadním krokem ve všech imunologických technikách je blokování. V této fázi postupu blokování spočívá v pokrytí všech míst na senzibilizovaných vrstvách všemi místy s molekulami poly-lysinu, ke kterým buňky nepřilnuly. To znamená, že brání jakémukoli nespecifickému sjednocení.
Normálně se používají blokovací roztoky s hovězím sérovým albuminem (BSA) v PBS pufru a nejlepších výsledků se dosáhne, čím delší je inkubační doba s tímto roztokem. Po každém kroku, včetně blokování, je nutné zbývající roztok vypláchnout..
Imunologické barvení nebo imunobarvení
Postup imunobarvení nebo imunobarvení bude záviset hlavně na tom, zda se jedná o přímou nebo nepřímou imunofluorescenci (viz níže)..
Pokud se jedná o primární nebo přímou imunofluorescenci, budou vzorky inkubovány s požadovanými protilátkami, které musí být navázány na fluorescenční barviva. Inkubační postup spočívá v přípravě naředění protilátky v roztoku, který bude také obsahovat BSA, ale v nižším poměru.
Pokud jde o sekundární nebo nepřímou imunofluorescenci, je třeba provést dvě po sobě následující inkubace. Nejprve s požadovanými protilátkami a poté s protilátkami, které jsou schopné detekovat konstantní oblasti primárních imunoglobulinů. Právě tyto sekundární protilátky jsou kovalentně vázány na fluorofory..
Tato technika je velmi univerzální a umožňuje současné značení více než jednoho antigenu na vzorek, pokud v případě přímé imunofluorescence existují primární protilátky spojené s různými fluorofory..
Pro současné značení v nepřímé imunofluorescenci je nutné zajistit, aby každá primární protilátka byla produkována u jiného zvířete, a aby každá sekundární protilátka byla navázána na jiný fluorofor..
Stejně jako blokování, inkubace s protilátkami poskytuje lepší výsledky, čím delší je doba inkubace. Po každém kroku je nutné opláchnout přebytečné protilátky, které se nevázaly na vzorky a v sekundární imunofluorescenci je nutné blokovat před přidáním sekundární protilátky.
Některé techniky používají jiná barvení, která nesouvisí s imunobarvením, jako je barvení jaderné DNA fluoroforem DAPI..
Shromáždění a pozorování
Během konečné inkubační doby s fluorofory je nutné, aby vzorky zůstaly ve tmě. Pro mikroskopické pozorování je běžné používat některé látky k uchování fluorescence fluoroforů navázaných na protilátky..
Typy
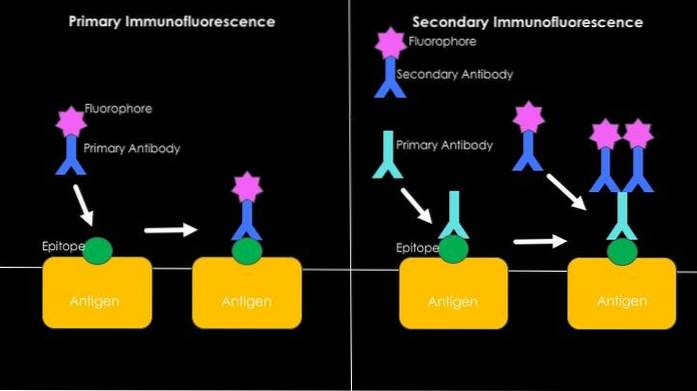
Přímá nebo primární imunofluorescence
Souvisí to s detekcí antigenů pomocí fluorescenčních protilátek. Hlavní výhodou použití této techniky je její rychlost, nicméně v procesu může nastat mnoho případů nespecifické vazby, zejména při studiu lidských sér, protože jsou bohaté na vysoce heterogenní protilátky..
Nepřímá nebo sekundární imunofluorescence
Je také známá jako „sendvičová“ technika a zahrnuje vývoj této techniky ve dvou krocích. První se týká použití nefluorescenční protilátky a její vazby na požadovaný antigen..
Proti konstantní oblasti této první protilátky (která nyní bude sloužit jako antigen) se použije druhá protilátka schopná ji rozpoznat, která je spojena s fluorescenční molekulou.
Vzhled fluorescenčního signálu bude výsledkem specifického rozpoznání mezi první nefluorescenční protilátkou a sledovaným antigenem; přítomnost této první protilátky určuje přítomnost druhé protilátky, která je označena a díky níž lze určit přítomnost nebo nepřítomnost antigenu.
Přestože je tato technika mnohem časově náročnější než přímá imunofluorescence (protože zahrnuje ještě jeden inkubační krok), nezahrnuje návrh fluorescenční protilátky pro každý studovaný antigen, což vede z ekonomického hlediska k životaschopnějšímu.
Kromě toho se jedná o citlivější techniku, pokud jde o zesílení signálu, protože více než jedna sekundární protilátka se může vázat na konstantní oblast primární protilátky, čímž zesiluje intenzitu fluorescenčního signálu..
Aplikace
Jak již bylo zmíněno dříve, imunofluorescence je extrémně univerzální technika, která má mnohostranné použití ve vědecké a klinické oblasti. Může být použit k zodpovězení ekologických, genetických a fyziologických otázek týkajících se mnoha organismů.
Mezi klinickými aplikacemi se používá k přímé diagnostice některých dermatologických onemocnění, a to buď pomocí přímé nebo nepřímé imunofluorescence na epiteliální tkáni studovaných pacientů..
Imunofluorescenční techniky byly k dispozici v jednobuněčných organismech, jako jsou kvasinky, pro vizualizaci intranukleárních a cytoplazmatických mikrotubulů, aktinu a souvisejících proteinů, 10nm vláken a dalších složek cytoplazmy, membrány a buněčných stěn..
Reference
- Protokol Abcam, Imunocytochemie a imunofluorescence. Obnoveno z abcam.com
- Greph, C. (2012). Fluorescenční barviva. Obnoveno z leica-microsystems.com
- Miller, D. M. a Shakest, D. C. (1995). Imunofluorescenční mikroskopie. v Metody v buněčné biologii (Sv. 48, str. 365-394). Academic Press, Inc..
- Odell, I. D., & Cook, D. (2013). Imunofluorescenční techniky. Journal of Investigative Dermatology, 133, 1-4.
- Princle, B. J. R., Adams, A. E. M., Druain, D. G. a Brian, K. (1991). Imunofluorescenční metody pro kvasinky. v Metody enzymologie (Sv. 194, str. 565-602). Academic Press, Inc..
- Schaeffer, M., Orsi, E. V, & Widelock, D. (1964). Aplikace imunofluorescence ve virologii veřejného zdraví. Bakteriologické recenze, 28(4), 402-408.
- Vrieling, E. G., & Anderson, D. M. (1996). Imunofluorescence ve výzkumu fytoplanktonu: aplikace a potenciál. J: Phycol., 32, 1-16.



Zatím žádné komentáře