
Beer-Lambertovy právní aplikace a řešená cvičení
The Beer-Lambertův zákon (Beer-Bouguer) je ten, který se týká absorpce elektromagnetického záření jednoho nebo více chemických druhů s jeho koncentrací a vzdáleností, kterou světlo cestuje v interakcích částice a fotonu. Tento zákon spojuje dva zákony do jednoho.
Bouguerův zákon (ačkoli uznání kleslo více na Heinricha Lamberta) stanoví, že vzorek absorbuje více záření, pokud jsou rozměry absorpčního média nebo materiálu větší; konkrétně jeho tloušťka, což je vzdálenost l že světlo cestuje při vstupu a odchodu.
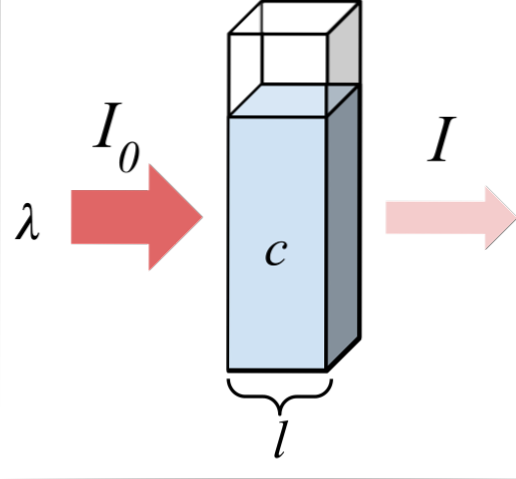
Horní obrázek ukazuje absorpci monochromatického záření; to znamená, že se skládá z jediné vlnové délky, λ. Absorpční médium je uvnitř optického článku, jehož tloušťka je l, a obsahuje chemické látky o koncentraci C.
Světelný paprsek má počáteční a konečnou intenzitu, označenou symboly I0 a já. Všimněte si, že po interakci s absorpčním médiem jsem méně než já0, což ukazuje, že došlo k absorpci záření. Čím jsou starší C Y l, menší budu s ohledem na mě0; to znamená, že bude více absorpce a méně propustnost.
Rejstřík článků
- 1 Co je zákon Beer-Lambert?
- 1.1 Absorbance a propustnost
- 1.2 Grafika
- 2 Aplikace
- 3 Vyřešená cvičení
- 3.1 Cvičení 1
- 3.2 Cvičení 2
- 4 Odkazy
Co je zákon Beer-Lambert?
Obrázek výše dokonale zahrnuje tento zákon. Absorpce záření ve vzorku se exponenciálně zvyšuje nebo snižuje jako funkce C nebo l. Abychom zákonům plně a snadno porozuměli, je nutné obejít jeho matematické aspekty.
Jak jsem právě zmínil, já0 a I jsou intenzity monochromatického světelného paprsku před a po světle. Některé texty upřednostňují použití symbolů P0 a P, které odkazují na energii záření a ne na jeho intenzitu. Zde bude vysvětlení pokračovat pomocí intenzit.
Pro linearizaci rovnice tohoto zákona je třeba použít logaritmus, obecně základ 10:
Log (já0/ I) = εlC
Termín (I.0/ I) udává, jak moc klesá intenzita produktu záření absorbovaného. Lambertův zákon zvažuje pouze l (εl), zatímco Beerův zákon l ignoruje, ale umisťuje C místo toho (εC). Horní rovnice je spojením obou zákonů, a proto je obecným matematickým výrazem pro Beer-Lambertův zákon.
Absorbance a propustnost
Absorbance je definována termínem Log (I0/ I). Rovnice je tedy vyjádřena takto:
A = εlC
Kde ε je extinkční koeficient nebo molární nasákavost, což je konstanta při dané vlnové délce.
Všimněte si, že pokud je tloušťka absorpčního média udržována konstantní, jako je ε, bude absorbance A záviset pouze na koncentraci C, absorpčních druhů. Je to také lineární rovnice, y = mx, kde Y je A a X to je C.
Jak se absorbance zvyšuje, propustnost klesá; to znamená, kolik záření se po absorpci podaří přenést. Jsou tedy inverzní. Ano, já0/ I označuje stupeň absorpce, I / I0 se rovná propustnosti. Vědět toto:
Já / já0 = T
(Já0/ I) = 1 / T.
Log (já0/ I) = Log (1 / T)
Ale, Log (já0/ I) se také rovná absorbanci. Vztah mezi A a T je tedy:
A = Log (1 / T)
A použití vlastností logaritmů a vědomí, že Log1 se rovná 0:
A = -LogT
Přenosy jsou obvykle vyjádřeny v procentech:
% T = I / I0∙ 100
Grafy
Jak již bylo uvedeno, rovnice odpovídají lineární funkci; proto se očekává, že při jejich vytváření grafů uvedou čáru.
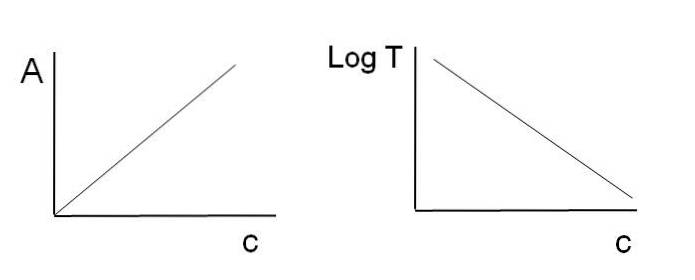
Všimněte si, že nalevo od obrázku nahoře je čára získaná grafem A proti C, a napravo řádek odpovídající grafu LogT proti C. Jeden má pozitivní sklon a druhý negativní; čím vyšší je absorbance, tím nižší je propustnost.
Díky této linearitě lze určit koncentraci absorpčních chemických látek (chromoforů), pokud je známo, kolik záření absorbují (A), nebo kolik záření se přenáší (LogT). Není-li tato linearita dodržena, říká se, že čelí odchylce od Beer-Lambertova zákona, pozitivní nebo negativní..
Aplikace
Obecně jsou níže zmíněny některé z nejdůležitějších aplikací tohoto zákona:
-Pokud chemická látka vykazuje barvu, je příkladným kandidátem na analýzu kolorimetrickými technikami. Ty jsou založeny na Beer-Lambertově zákoně a umožňují určit koncentraci analytů jako funkci absorbance získané spektrofotometrem..
-Umožňuje konstrukci kalibračních křivek, pomocí kterých se při zohlednění maticového účinku vzorku stanoví koncentrace sledovaného druhu.
-Je široce používán k analýze proteinů, protože několik aminokyselin má významné absorpce v ultrafialové oblasti elektromagnetického spektra..
-Chemické reakce nebo molekulární jevy, které zahrnují změnu barvy, lze analyzovat pomocí hodnot absorbance na jedné nebo více vlnových délkách..
-Pomocí vícerozměrné analýzy lze analyzovat složité směsi chromoforů. Tímto způsobem lze určit koncentraci všech analytů a také lze směsi klasifikovat a navzájem odlišit; například vyloučit, zda dva stejné minerály pocházejí ze stejného kontinentu nebo konkrétní země.
Vyřešená cvičení
Cvičení 1
Jaká je absorbance roztoku vykazujícího propustnost 30% při vlnové délce 640 nm??
Chcete-li to vyřešit, přejděte k definicím absorbance a propustnosti.
% T = 30
T = (30/100) = 0,3
A s vědomím, že A = -LogT, je výpočet přímočarý:
A = -Log 0,3 = 0,5228
Všimněte si, že mu chybí jednotky.
Cvičení 2
Pokud řešení z předchozího cvičení sestává z druhu W, jehož koncentrace je 2,30 × 10-4 M a za předpokladu, že buňka má tloušťku 2 cm: jaká by měla být její koncentrace, aby se dosáhlo prostupnosti 8%??
Mohlo by to být vyřešeno přímo pomocí této rovnice:
-LogT = εlC
Hodnota ε však není známa. Musí se proto počítat s předchozími údaji a předpokládá se, že zůstává konstantní v širokém rozsahu koncentrací:
ε = -LogT / lC
= (-Log 0,3) / (2 cm x 2,3 ∙ 10-4 M)
= 1136,52 M-1∙ cm-1
A teď můžete přistoupit k výpočtu s% T = 8:
c = -LogT / el
= (-Log 0,08) / (1136,52 M-1∙ cm-1 x 2 cm)
= 4,82 ∙ 10-4 M
Poté stačí, aby druh W zdvojnásobil svoji koncentraci (4,82 / 2,3), aby snížil procento propustnosti z 30% na 8%..
Reference
- Day, R., & Underwood, A. (1965). Kvantitativní analytická chemie. (páté vydání). PEARSON Prentice Hall, s. 469-474.
- Skoog D.A., West D.M. (1986). Instrumentální analýza. (druhé vydání). Interamericana., Mexiko.
- Soderberg T. (18. srpna 2014). Beer-Lambertův zákon. Chemistry LibreTexts. Obnoveno z: chem.libretexts.org
- Clark J. (květen 2016). Beer-Lambertův zákon. Obnoveno z: chemguide.co.uk
- Kolorimetrická analýza: Beerův zákon nebo spektrofotometrická analýza. Obnoveno z: chem.ucla.edu
- Dr. J.M. Fernandez Alvarez. (s.f.). Analytická chemie: manuál řešených problémů. [PDF]. Obnoveno z: dadun.unav.edu



Zatím žádné komentáře