
Molární hmotnost, jak ji vypočítat, příklady a řešená cvičení
The molární hmotnost je intenzivní vlastnost hmoty, která souvisí s konceptem krtka s měřením hmotnosti. Stručněji řečeno, je to množství hmoty odpovídající jednomu molu látky; to znamená, co „váží“ číslo Avogadra (6,022 · 102. 3) stanovených částic.
Jeden mol jakékoli látky bude obsahovat stejný počet částic (ionty, molekuly, atomy atd.); jeho hmotnost se však bude lišit, protože jeho molekulární rozměry jsou definovány počtem atomů a izotopů, které tvoří jeho strukturu. Čím hmotnější je atom nebo molekula, tím větší je jeho molární hmotnost..
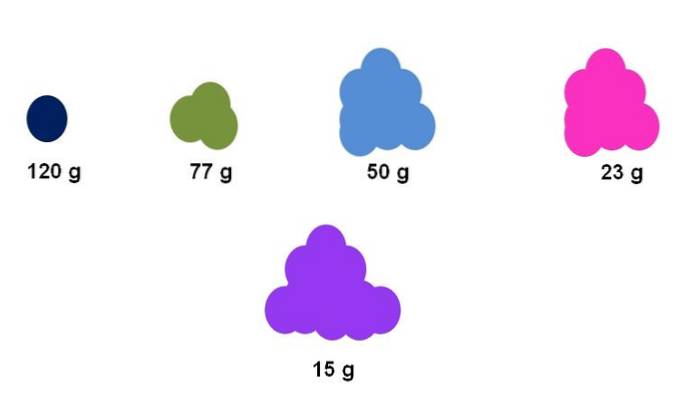
Předpokládejme například, že pro pět různých sloučenin je shromážděn přesně jeden mol (horní obrázek). Pomocí váhy byla změřena hmotnost každého klastru, vyjádřená níže. Tato hmotnost odpovídá molární hmotnosti. Ze všech má fialová sloučenina nejlehčí částice, zatímco tmavě modrá sloučenina má nejtěžší částice..
Všimněte si, že je ukázán zobecněný a přehnaný trend: čím vyšší je molární hmotnost, tím menší je množství vzorku, které musí být umístěno na váhu. Tento objem hmoty však také velmi závisí na stavu agregace každé sloučeniny a její hustotě..
Rejstřík článků
- 1 Jak vypočítáte molární hmotnost?
- 1.1 Definice
- 1.2 Prvky
- 1.3 Sloučeniny
- 2 Příklady
- 3 Vyřešená cvičení
- 3.1 Cvičení 1
- 3.2 Cvičení 2
- 3.3 Cvičení 3
- 4 Odkazy
Jak vypočítáte molární hmotnost?

Definice
Molární hmotnost lze vypočítat na základě její definice: množství hmoty na mol látky:
M = gramy látky / mol látky
Ve skutečnosti je g / mol jednotka, ve které je obvykle vyjádřena molární hmotnost, spolu s kg / mol. Pokud tedy víme, kolik molů sloučeniny nebo prvku máme, a zvážíme je, dostaneme se přímo k jejich molární hmotnosti použitím jednoduchého dělení.
Elementy
Molární hmotnost se netýká pouze sloučenin, ale také prvků. Koncept krtků vůbec nediskriminuje. Proto s pomocí periodické tabulky lokalizujeme relativní atomové hmotnosti pro zájmový prvek a vynásobíme jeho hodnotu 1 g / mol; to je Avogadrova konstanta, MNEBO.
Například relativní atomová hmotnost stroncia je 87,62. Pokud chceme mít jeho atomovou hmotnost, bylo by to 87,62 amu; ale pokud to, co hledáme, je jeho molární hmotnost, pak to bude 87,62 g / mol (87,62 · 1 g / mol). A tak jsou molární hmotnosti všech ostatních prvků získány stejným způsobem, aniž by bylo nutné provádět uvedené násobení..
Sloučeniny
Molární hmotnost sloučeniny není nic jiného než součet relativních atomových hmotností jejích atomů vynásobený MNEBO.
Například molekula vody, HdvaNebo má tři atomy: dva vodík a jeden kyslík. Relativní atomové hmotnosti H a O jsou 1,008, respektive 15,999. Přidáme tedy jejich hmotnosti vynásobením počtem atomů přítomných v molekule sloučeniny:
2 H (1,008) = 2,016
1 O (15 999) = 15 999
M(HdvaO) = (2 016 + 15 999) 1 g / mol = 18 015 g / mol
Je poměrně běžnou praxí vynechat MNEBO na konci:
M(HdvaO) = (2 016 + 15 999) = 18 015 g / mol
Molární hmotou se rozumí jednotky g / mol.
Příklady
Jedna z nejznámějších molárních hmot byla právě zmíněna: voda 18 g / mol. Ti, kteří jsou obeznámeni s těmito výpočty, dosáhnou bodu, kdy si budou moci zapamatovat některé molární hmotnosti, aniž by je museli hledat nebo je počítat výše uvedeným způsobem. Některé z těchto molárních hmot, které slouží jako příklady, jsou následující:
-NEBOdva: 32 g / mol
-Ndva: 28 g / mol
-NH3: 17 g / mol
-CH4: 16 g / mol
-COdva: 44 g / mol
-HCl: 36,5 g / mol
-HdvaSW4: 98 g / mol
-CH3COOH: 60 g / mol
-Fe: 56 g / mol
Dané hodnoty jsou zaokrouhleny. Pro přesnější účely by měly být molární hmotnosti vyjádřeny na více desetinných míst a počítány s náležitými a přesnými relativními atomovými hmotnostmi.
Vyřešená cvičení
Cvičení 1
Analytickými metodami bylo odhadnuto, že roztok vzorku obsahuje 0,0267 mol analytu D. Rovněž je známo, že jeho hmotnost odpovídá 14% vzorku, jehož celková hmotnost je 76 gramů. Vypočítejte molární hmotnost domnělého analytu D.
Musíme určit hmotnost D, která je rozpuštěna v roztoku. Pokračujeme:
Hmotnost (D) = 76 g 0,14 = 10,64 g D
To znamená, že vypočítáme 14% ze 76 gramů vzorku, což odpovídá gramům analytu D. Poté a nakonec použijeme definici molární hmotnosti, protože k jejímu výpočtu máme dostatek údajů:
M(D) = 10,64 g D / 0,0267 mol D
= 398,50 g / mol
Což znamená: jeden mol (6,022102. 3) molekul Y má hmotnost rovnou 398,50 gramů. Díky této hodnotě můžeme vědět, kolik z Y chceme na váze navážit pro případ, že bychom například chtěli připravit roztok s molární koncentrací 5 · 10-3 M; tj. rozpusťte 0,1993 gramů Y v jednom litru rozpouštědla:
5 10-3 (mol / L). (398,50 g / mol) = 0,1993 g Y
Cvičení 2
Vypočítejte molární hmotnost kyseliny citronové s vědomím, že její molekulární vzorec je C6H8NEBO7.
Stejný vzorec C.6H8NEBO7 Usnadňuje pochopení výpočtu, protože nám sděluje najednou počet atomů C, H a O, které jsou v kyselině citronové. Proto opakujeme stejný krok provedený pro vodu:
6 C · (12,0107) = 72,0642
8 H (1008) = 8 064
7 O (15 999) = 111993
M(kyselina citrónová) = 72,0642 + 8,064 + 111,993
= 192,1212 g / mol
Cvičení 3
Vypočítejte molární hmotnost pentahydrátu síranu měďnatého, CuSO45HdvaNEBO.
Již dříve víme, že molární hmotnost vody je 18,015 g / mol. To nám pomáhá zjednodušit výpočty, protože to pro tuto chvíli vynecháme a zaměříme se na bezvodou sůl CuSO4.
Máme relativní atomové hmotnosti mědi 63,546 a síry 32,065. U těchto údajů postupujeme stejným způsobem jako u cvičení 2:
1 Cu (63 546) = 63 546
1 S (32 065) = 32 065
4 O (15 999) = 63 999
M(CuSO4) = 63 546 + 32 065 + 63 996
= 159,607 g / mol
Nás ale zajímá molární hmotnost pentahydrátu, ne bezvodá. K tomu musíme k výsledku přidat odpovídající množství vody:
5 hdvaO = 5 (18 015) = 90 075
M(CuSO45HdvaO) = 159,607 + 90,075
= 249,682 g / mol
Reference
- Whitten, Davis, Peck a Stanley. (2008). Chemie. (8. vydání). Učení CENGAGE.
- Wikipedia. (2020). Molární hmotnost. Obnoveno z: en.wikipedia.org
- Nissa García. (2020). Co je molární hmotnost? Definice, vzorec a příklady. Studie. Obnoveno z: study.com
- Dr. Kristy M. Bailey. (s.f.). Výukový program stechiometrie
Nalezení molární hmotnosti. Obnoveno z: occc.edu - Helmenstine, Anne Marie, Ph.D. (02. prosince 2019). Příklad problému s molární hmotností. Obnoveno z: thoughtco.com



Zatím žádné komentáře