
Struktura, druhy, vlastnosti železných kovů

The železitý kov Jsou to ty, které obsahují železo (Fe) a také malé množství jiných kovů, které se přidávají, aby jejich slitiny získaly určité příznivé vlastnosti. Ačkoli železo může existovat v různých oxidačních stavech, jsou nejčastější +2 (železný) a +3 (železitý).
Termín „železo“ se však týká přítomnosti železa bez ohledu na jeho oxidační stav v materiálu. Železo je čtvrtým nejhojnějším prvkem v zemské kůře, ale globálně je hlavním zemským prvkem. Z historického a průmyslového hlediska proto železné kovy hrály roli ve vývoji člověka..

To byl případ kvůli jeho velkému množství a upravitelným vlastnostem. Tyto železné kovy vycházejí z těžby železa z mineralogických zdrojů, jako jsou: hematit (FedvaNEBO3), magnetit (Fe3NEBO4) a siderit (FeCO3). Kvůli výkonu jsou tyto oxidy nejžádanější při zpracování železa.
Horní obrázek ukazuje žhavý litinový „ohnivý jazyk“. Nejdůležitější ze všech železných kovů je slitina železa s malým množstvím přidaného uhlíku: ocel..
Rejstřík článků
- 1 Struktura
- 2 Vlastnosti a vlastnosti
- 3 příklady
- 3.1 Tepané nebo měkké železo
- 3.2 Surové železo nebo surové železo
- 3.3 Čisté železo
- 3.4 Litina nebo litina (slévárny)
- 3.5 Šedá litina
- 3.6 Tvárná litina
- 3.7 Oceli
- 4 Ocel a její aplikace
- 4.1 Uhlík nebo konstrukční ocel
- 4.2 Křemíková ocel
- 4.3 Pozinkovaná ocel
- 4.4 Nerezová ocel
- 4.5 Manganová ocel
- 4.6 Invarová ocel
- 5 Reference
Struktura
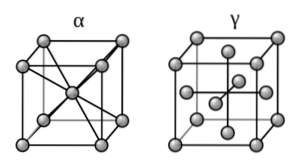
Protože železo je hlavní složkou železných kovů, jejich struktury sestávají z krystalických deformací jejich čisté pevné látky.
Železné slitiny jako ocel proto nejsou ničím jiným než intersticiálním začleněním dalších atomů do krystalového uspořádání železa..
Jaké je toto uspořádání? Železo tvoří allotropy (různé pevné struktury) v závislosti na teplotě, které je vystaveno, a mění své magnetické vlastnosti. Při pokojové teplotě tedy představuje uspořádání bcc, známé také jako alfa-železo (krychle vlevo, horní obrázek).
Na druhou stranu, v rozmezí vysokých teplot (912-1394 (ºC)), projevuje uspořádání ccp nebo fcc: železo-gama (krychle vpravo). Jakmile je tato teplota překročena, železo se vrací do formy BCC, aby se konečně roztavilo.
Tato změna ve struktuře alfa-gama je známá jako fázová transformace. Fáze gama je schopna „zachytit“ atomy uhlíku, zatímco fáze alfa není.
V případě oceli lze tedy její strukturu vizualizovat jako sady atomů železa obklopujících atom uhlíku..
Tímto způsobem struktura železných kovů závisí na distribuci fází železa a atomů jiných druhů v pevné látce..
Vlastnosti a vlastnosti
Čisté železo je měkký a velmi tvárný kov, vysoce citlivý na korozi a oxidaci z vnějších faktorů. Pokud však obsahuje různé podíly jiného kovu nebo uhlíku, získává nové vlastnosti a vlastnosti..
Právě tyto změny činí železné kovy užitečnými pro nesčetné aplikace..
Slitiny železa jsou obecně silné, odolné a houževnaté, s jasně šedivými barvami a magnetickými vlastnostmi..
Příklady
Tepané železo nebo sladké
Má obsah uhlíku méně než 0,03%. Má stříbrnou barvu, snadno rezaví a vnitřně praská. Kromě toho je tvárný a tvarovatelný, s dobrým vodičem elektřiny a obtížně svařovatelným..
Je to typ železného kovu, který člověk poprvé použil při výrobě zbraní, nádobí a budov. V současné době se používá na desky, nýty, mřížoví atd. Jelikož je to dobrý elektrický vodič, používá se v jádře elektromagnetů.
Surové železo nebo litina
V původním produktu vysoké pece obsahuje 3–4% uhlíku a stopy dalších prvků, jako je křemík, hořčík a fosfor. Jeho hlavním využitím je zasahování do výroby dalších železných kovů.
Čisté železo
Je to šedobílý kov s magnetickými vlastnostmi. Přes svou tvrdost je křehký a křehký. Jeho teplota tání je vysoká (1 500 ° C). A rychle oxiduje.
Je to dobrý elektrický vodič, a proto se používá v elektrických a elektronických součástkách. Jinak je to málo užitečné.
Litina nebo litina (slévárny)
Mají vysoký obsah uhlíku (mezi 1,76% a 6,67%). Jsou tvrdší než ocel, ale křehčí. Tají při nižší teplotě než čisté železo, kolem 1100 ° C.
Protože je tvarovatelný, je možné s ním vyrábět kusy různých velikostí a složitosti. U tohoto typu železa se používá šedá litina, která mu dodává stabilitu a tvarovatelnost..
Mají vyšší odolnost proti korozi než ocel. Jsou také levné a husté. Představují tekutost při relativně nízkých teplotách a jsou schopné plnit formy.
Mají také dobré kompresní vlastnosti, ale jsou křehké a lámou se před ohýbáním, takže nejsou vhodné pro velmi komplikované kusy..
Šedá litina
Je to nejběžnější litina, jejíž šedý odstín je způsoben přítomností grafitu. Má koncentraci uhlíku mezi 2,5% a 4%; navíc obsahuje 1-3% silikonu ke stabilizaci grafitu.
Má mnoho atributů základních litin a je vysoce tekutý. Je nepružný a ohýbá se krátce před zlomením.
Tvárná litina
Přidává se uhlík ve formě sférické žuly v koncentraci mezi 3,2% a 3,6%. Sférický tvar grafitu mu dává větší odolnost proti nárazu a tvárnost než šedé železo, což umožňuje jeho použití v podrobných a hranatých designech.
Oceli
Obsah uhlíku mezi 0,03% a 1,76%. Mezi jeho vlastnosti patří tvrdost, houževnatost a odolnost vůči fyzickému úsilí. Obecně snadno rez. Jsou svařitelné a lze je zpracovat v kování nebo mechanicky.
Mají také větší tvrdost a menší tekutost než litiny. Z tohoto důvodu potřebují vysoké teploty pro tok ve formách..
Ocel a její aplikace

Existuje několik druhů oceli, každý s různými aplikacemi:
Uhlík nebo konstrukční ocel
Koncentrace uhlíku se může lišit a stanoví se čtyři formy: měkká ocel (0,25% uhlík), polosladká ocel (0,35% uhlík), polotvrdá ocel (0,45% uhlík) a tvrdá (0,5%).
Používá se při výrobě nástrojů, ocelových plechů, železničních vozidel, hřebíků, šroubů, automobilů a lodí.
Křemíková ocel
Také se nazývá elektrická ocel nebo magnetická ocel. Jeho koncentrace křemíku se pohybuje mezi 1% a 5%, Fe se pohybuje mezi 95% a 99% a uhlík má 0,5%.
Kromě toho se přidá menší množství manganu a hliníku. Má velkou tvrdost a vysoký elektrický odpor. Používá se při výrobě magnetů a elektrických transformátorů.
Galvanizovaná ocel
Je potažen zinkovým povlakem, který jej chrání před rzí a korozí. Proto je užitečné pro výrobu potrubních dílů a nástrojů..
Nerezová ocel
Má složení Cr (14-18%), Ni (7-9%), Fe (73-79%) a C (0,2%). Je odolný vůči oxidaci a korozi. Používá se při výrobě příborů i řezného materiálu.
Manganová ocel
Jeho složení je Mn (10–18%), Fe (82–90%) a C (1,12%). Je tvrdý a odolný proti opotřebení. Používá se na železniční kolejnice, trezory a brnění.
Ocel Invar
Má 36% Ni, 64% Fe a 0,5% uhlíku. Má nízký koeficient roztažnosti. Používá se při konstrukci indikátorových vah; například: svinovací metry.
Reference
- Whitten, Davis, Peck a Stanley. (2008). Chemie. 8. vydání, CENGAGE Learning.
- Správce (19. září 2017). Co je to železo, odkud pochází a kolik druhů železa je tam. Citováno dne 22. dubna 2018 z: termiser.com
- Wikipedia. (2018). Žehlička. Citováno dne 22. dubna 2018 z: en.wikipedia.org
- Kovy. Obecné vlastnosti. Těžba a klasifikace kovů. Citováno dne 22. dubna 2018 z: edu.xunta.gal
- Jose Ferrer. (Leden 2018). Metalurgická charakterizace železných a neželezných materiálů. Citováno dne 22. dubna 2018 z: steemit.com
- Eseje, Velká Británie. (Listopad 2013). Základní struktury železných kovů. Citováno dne 22. dubna 2018 z: ukessays.com
- Cdang. (7. července 2011). Iron Alpha & Iron Gamma. [Postava]. Citováno dne 22. dubna 2018 z: commons.wikimedia.org
- Włodi. (15. června 2008). Prýmky z nerezové oceli. [Postava]. Citováno dne 22. dubna 2018 z: commons.wikimedia.org


Zatím žádné komentáře