
Struktura methoxyethanu, vlastnosti, získávání, použití, rizika

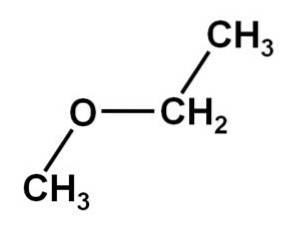
The methoxyethan Je to organická sloučenina z rodiny etherů nebo alkoxidů. Jeho chemický vzorec je CH3OCHdvaCH3. Nazývá se také methylethylether nebo ethylmethylether. Jedná se o plynnou sloučeninu při teplotě místnosti a její molekula má dvě methylové skupiny -CH3, jeden přímo vázaný na kyslík a druhý na ethyl-CHdvaCH3.
Methoxyethan je bezbarvý plyn, rozpustný ve vodě a mísitelný s etherem a ethylalkoholem. Protože se jedná o ether, jedná se o málo reaktivní sloučeninu, která však může reagovat při vysokých teplotách s některými koncentrovanými kyselinami..
Obecně se získává takzvanou Williamsonovou syntézou, která zahrnuje použití alkoxidu sodného a alkyljodidu. Jeho rozklad byl zase studován za různých podmínek.
Methoxyethan se používá ve výzkumných laboratořích s různými cíli, například při studiu polovodičových nanomateriálů nebo při pozorování mezihvězdné hmoty v souhvězdích a velkých molekulárních mračnech vesmíru..
Ve skutečnosti byl díky velmi citlivým dalekohledům (interferometrům) detekován na určitých místech v mezihvězdném prostoru..
Rejstřík článků
- 1 Struktura
- 2 Názvosloví
- 3 Fyzikální vlastnosti
- 3.1 Fyzický stav
- 3,2 Molekulová hmotnost
- 3.3 Teplota tání
- 3.4 Bod varu
- 3.5 Bod vzplanutí
- 3.6 Teplota samovznícení
- 3.7 Specifická hmotnost
- 3.8 Index lomu
- 3.9 Rozpustnost
- 4 Chemické vlastnosti
- 4.1 Tepelný rozklad
- 4.2 Fotocitlivý rozklad
- 5 Získání
- 6 Umístění ve vesmíru
- 7 Použití methoxyethanu
- 7.1 Pro studie o mezihvězdné hmotě
- 7.2 Dedukovat chemické transformace v různých studijních oborech
- 7.3 Potenciální použití v polovodičích
- 8 Rizika
- 9 Odkazy
Struktura
Methoxyethanová sloučenina má methylovou skupinu -CH3 a ethylová skupina -CHdvaCH3 oba jsou připojeny ke kyslíku.
Jak je vidět, v této molekule jsou dvě methylové skupiny, jedna navázaná na kyslík CH3-O a další patřící do ethylu -CHdva-CH3.
V základním stavu nebo stavu nižší energie je methylová skupina -CHdva-CH3 je na místě trans s ohledem na methylovou skupinu vázanou na kyslík, to znamená na diametrálně opačném místě, přičemž jako referenční je použita CH vazbadva-O. Proto se mu někdy říká trans-ethylmethylether.
Tato molekula může podstoupit zkroucení na CH vazbědva-Nebo který umístí methyl do jiné prostorové polohy než trans , methylové skupiny -CH3 jsou velmi blízko u sebe a tato torze generuje energetický přechod detekovatelný citlivými nástroji.
Nomenklatura
- Methoxyethan.
- Methylethylether.
- trans-Ethylmethylether (hlavně v anglicky mluvící literatuře, překlad z angličtiny trans-ethylmethylether).
Fyzikální vlastnosti
Fyzický stav
Bezbarvý plyn
Molekulární váha
60,096 g / mol
Bod tání
-113,0 ° C
Bod varu
7,4 ° C
Bod vzplanutí
1,7 ° C (metoda uzavřeného kelímku).
Teplota samovznícení
190 ° C
Specifická hmotnost
0,7251 při 0 ° C / 0 ° C (je méně hustý než voda, ale těžší než vzduch).
Index lomu
1,3420 při 4 ° C
Rozpustnost
Rozpustný ve vodě: 0,83 mol / l
Rozpustný v acetonu. Mísitelný s ethylalkoholem a ethyletherem.
Chemické vlastnosti
Methoxyethan je ether, takže je relativně nereaktivní. Vazba uhlík-kyslík-uhlík C-O-C je velmi stabilní vůči zásadám, oxidačním a redukčním činidlům. Je degradován pouze kyselinami, ale probíhá pouze za energických podmínek, tj. S koncentrovanými kyselinami a vysokými teplotami..
Má však tendenci oxidovat za přítomnosti vzduchu a vytvářet nestabilní peroxidy. Pokud jsou nádoby, které ji obsahují, vystaveny teplu nebo ohni, nádoby prudce explodují.
Tepelný rozklad
Když se methoxyethan zahřeje na teplotu mezi 450 a 550 ° C, rozloží se na acetaldehyd, ethan a methan. Tato reakce je katalyzována přítomností ethyljodidu, který je obvykle přítomen v laboratorních vzorcích methoxyethanu, protože se používá k jeho získání..
Fotocitlivý rozklad
Methoxyethan ozářený rtuťovou výbojkou (vlnová délka 2537 Å) rozkládá za vzniku široké škály sloučenin, včetně: vodíku, 2,3-dimethoxybutanu, 1-ethoxy-2-methoxypropanu a methylvinyletheru..
Konečné produkty závisí na době ozáření vzorku, protože při ozařování pokračují ty, které se zpočátku vytvářejí, a pak vznikají nové sloučeniny..
Prodloužením doby ozařování lze také vytvořit propan, methanol, ethanol, aceton, 2-butanon, oxid uhelnatý, ethyl-n-propylether a methyl-sek-butylether..
Získávání
Jako nesymetrický ether lze methoxyethan získat reakcí mezi methoxidem sodným CH3ONa a ethyljodid CH3CHdvaI. Tento typ reakce se nazývá Williamsonova syntéza.
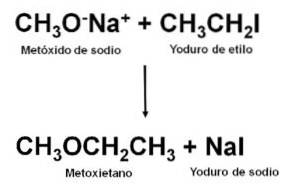
Po provedení reakce se směs destiluje, čímž se získá ether.
Lze jej také získat za použití ethoxidu sodného CH3CHdvaONa a methylsulfát (CH3)dvaSW4.
Umístění ve vesmíru
The trans-Ethylmethylether byl detekován v mezihvězdném médiu v oblastech, jako je souhvězdí Orion KL a v obrovském molekulárním mračnu W51e2.

Detekce této sloučeniny v mezihvězdném prostoru spolu s analýzou jejího množství pomáhá vytvářet modely mezihvězdné chemie..
Použití methoxyethanu
Methoxyethan nebo methylethylether se používá většinou při laboratorních experimentech pro vědecký výzkum.
Pro studie o mezihvězdné hmotě
Methoxyethan je organická molekula s vnitřními rotacemi a je chemickou sloučeninou, která nás zajímá pro studium mezihvězdné hmoty..
Vnitřní rotace jeho methylových skupin produkují energetické přechody v mikrovlnné oblasti.
Proto je lze detekovat vysoce citlivými dalekohledy, jako je Atacama Large Millimeter / submillimeter Ensemble nebo ALMA. Pole Atacama Large Millimeter / Subillimeter Array).

Díky své vnitřní rotaci a velkým vesmírným observatořím trans-Methylethylether byl nalezen v souhvězdí Orion a v obrovském molekulárním mračnu W51e2.
Dedukovat chemické transformace v různých studijních oborech
Někteří vědci pozorovali tvorbu methoxyethanu nebo methylethyletheru, když byla směs ethylenu CH ozářena elektrony.dva= CHdva a methanol CH3Ach.
Reakční mechanismus prochází tvorbou radikálu CH3O •, který napadá elektronově bohatou dvojnou vazbu CHdva= CHdva. Výsledný adukt CH3-O-CHdva-CHdva• zachycuje vodík z CH3OH a tvoří methylethylether CH3-O-CHdva-CH3.
Studium tohoto typu reakcí vyvolaných ozářením elektronů je užitečné v oblasti biochemie, protože bylo zjištěno, že mohou způsobit poškození DNA, nebo v oblasti organokovové chemie, protože podporuje tvorbu nanostruktur.
Dále je známo, že při interakci elektromagnetického nebo částicového záření s kondenzovanou hmotou ve vesmíru vzniká velké množství sekundárních elektronů..
Proto se odhaduje, že tyto elektrony mohou iniciovat chemické transformace v mezihvězdné prachové látce. Proto je důležité studovat v těchto reakcích methylethylether..
Potenciální použití v polovodičích
Prostřednictvím výpočetních výpočtových metod někteří vědci zjistili, že methoxyethan nebo methylethylether mohou být adsorbovány grafenem dopovaným galliem (Ga) (všimněte si, že adsorpce se liší od absorpce).
Grafen je nanomateriál složený z atomů uhlíku, které jsou uspořádány v hexagonálním vzoru..

K adsorpci methoxyethanu na dotovaném grafenu dochází prostřednictvím interakce mezi kyslíkem v etheru a atomem gália na povrchu nanomateriálu. Díky této adsorpci dochází k čistému přenosu náboje z etheru na gálium..
Po adsorpci methylethyletheru a díky tomuto přenosu náboje vykazuje grafen dopovaný gáliem polovodičové vlastnosti typu p.
Rizika
Methoxyethan je vysoce hořlavý.
Při kontaktu se vzduchem má tendenci vytvářet nestabilní a výbušné peroxidy.
Reference
- NÁS. Národní lékařská knihovna. (2019). Ethylmethylether. Obnoveno z: pubchem.ncbi.nlm.nih.gov.
- Irvine W.M. (2019) Ethylmethylether (C.dvaH5OCH3). In: Gargaud M. a kol. (eds). Encyklopedie astrobiologie. Springer, Berlín, Heidelberg. Obnoveno z odkazu.springer.com.
- Zatřetí, B. a kol. (2015). Hledání transethylmethyletheru v systému Orion KL. Astronomie a astrofyzika. 582, L1 (2015). Obnoveno z ncbi.nlm.nih.gov.
- Filseth, S.V. (1969). Merkur 6 (3P1) Fotocitlivý rozklad methylethyletheru. The Journal of Physical Chemistry. Svazek 73, číslo 4, duben 1969, 793-797. Obnoveno z pubs.acs.org.
- Casanova, J.Jr. (1963). Příprava studentů a manipulace s plynem-methylethyletherem. Journal of Chemical Education. Svazek 40, číslo 1, leden 1963. Obnoveno z pubs.acs.org.
- Ure, W. a Young, J.T. (1933a). O mechanismu plynných reakcí. I. Tepelný rozklad methylethyletheru. The Journal of Physical Chemistry, sv. XXXVII, č. 9: 1169-1182. Obnoveno z pubs.acs.org.
- Ure, W. a Young, J.T. (1933b). O mechanismu plynných reakcí. II. Homogenní katalýza při rozkladu methylethyletheru. The Journal of Physical Chemistry, 37, 9, 1183-1190. Obnoveno z pubs.acs.org.
- Shokuhi Rad, A. a kol. (2017). DFT Studie adsorpce diethylu, ethylmethylu a dimethyletheru na povrchu grafenu dopovaného galliem. Aplikovaná věda o povrchu. Svazek 401, 15. dubna 2017, strany 156-161. Obnoveno ze sciencedirect.com.
- Schmidt, F. a kol. (2019). Elektronem indukovaná tvorba ethylmethyletheru v kondenzovaných směsích methanolu a ethylenu. J. Phys. Chem. A 2019, 123, 1, 37-47. Obnoveno z pubs.acs.org.



Zatím žádné komentáře