
Vlastnosti, struktura a vazebná křivka oxyhemoglobinu
NEBOxihemoglobin Je to název, který hemoglobin získává, když se váže na kyslík. Hemoglobin je protein nacházející se uvnitř červených krvinek, jehož hlavní funkcí je transport kyslíku z plic do tkání..
První živé bytosti byly jednobuněčné a žily v kapalném prostředí, ze kterého byly vyživovány a ze kterého likvidovaly svůj odpad, jako některé dnes existující organismy. Za těchto podmínek se těchto procesů dosahuje jednoduchými difúzními mechanismy, protože buněčná stěna je v těsném kontaktu s médiem, které ji dodává..
Vývoj stále složitějších mnohobuněčných organismů znamenal, že se vnitřní buňky značně vzdálily od prostředí, takže difúzní mechanismy jako jediný zdroj dodávek se staly nedostatečnými..
Byly tedy vyvinuty specializované systémy pro získávání živin a plynů, jako je zažívací systém a dýchací systém, a také transportní mechanismy, které tyto živiny a plyny přibližují k buňce: kardiovaskulární systém.
K výrobě energie ve formě molekul ATP potřebují buňky kyslík. Vzhledem k tomu, že ATP nelze skladovat, musí být neustále syntetizován, což znamená trvalou potřebu kyslíku buňkami..
Hemoglobin se evolučně ukázal jako transportér plynu, který „vyřešil“ problém přenosu kyslíku z prostředí do buňky..
Rejstřík článků
- 1 Vlastnosti a struktura
- 1.1 K čemu je hemoglobin?
- 1.2 Jaká je molekula hemoglobinu?
- 1.3 Jak je na tom skupina hemu?
- 1.4 Jak vzniká oxyhemoglobin?
- 1.5 Jaké je maximální množství kyslíku, které může hemoglobin nést?
- 2 Křivka vazby oxyhemoglobinu
- 3 Odkazy
Vlastnosti a struktura
Hovoříme-li o vlastnostech a struktuře oxyhemoglobinu, je třeba se zmínit o hemoglobinu, protože oxyhemoglobin není nic jiného než hemoglobin vázaný na kyslík. Proto budou od nynějška popsány společné charakteristiky molekuly za přítomnosti dotyčného plynu či nikoli..
K čemu je hemoglobin?
Hemoglobin je nezbytný pro transport kyslíku do tkání v takovém množství a rychlosti, jaké si to vyžadují, vzhledem k tomu, že kyslík má tak malou rozpustnost v krvi, že jeho transport difúzí by nebyl dostatečný pro zásobování tkání.
Jak je molekula hemoglobinu?
Hemoglobin je tetramerní protein (který má čtyři podjednotky), má sférický tvar a molekulovou hmotnost 64 kDa.
Jeho čtyři podjednotky tvoří jednu funkční jednotku, kde každá z nich vzájemně ovlivňuje druhou. Každá podjednotka je složena z polypeptidového řetězce, globinu a protetické skupiny, hemu nebo „hemu“ skupiny, která působí jako kofaktor a není tvořena aminokyselinami; to znamená, že to není v přírodě bílkovina.
Globin se vyskytuje ve dvou formách: alfa globin a beta globin. Hemoglobinový tetramer se skládá z dvojice alfa globinových řetězců (141 aminokyselin) a dvojice beta globinových řetězců (146 aminokyselin).
Každý ze čtyř polypeptidových řetězců je připojený k hemové skupině, která má ve středu atom železa v železném stavu (Fe2 +).
Jak je na tom skupina hemu?
Hemovou skupinou je porfyrinový kruh, který je tvořen čtyřmi pyrrolickými kruhy (heterocyklické aromatické sloučeniny vzorce C4H5N) spojené methylovými můstky. Železo ve železném stavu, které je ve středu, je připojeno ke struktuře prostřednictvím koordinovaných dusíkových vazeb.
Každá skupina hemu je schopna vázat se na jednu molekulu kyslíku, takže každá molekula hemoglobinu může vázat pouze 4 molekuly plynu.
Lidské tělo obsahuje přibližně 2,5 x 1013 erytrocytů, což jsou krevní buňky, které vytvářejí a transportují hemoglobin. Každý erytrocyt má přibližně 280 milionů molekul hemoglobinu a poté může nést více než 1 miliardu molekul kyslíku.
Jak vzniká oxyhemoglobin?
Oxyhemoglobin vzniká po spojení atomu kyslíku s každým atomem železa ve železnatém stavu, který se nachází v každé hemové skupině molekuly hemoglobinu.
Termín oxyhemoglobin se tedy týká okysličeného a chemicky neoxidovaného hemoglobinu, protože při kombinaci s kyslíkem a železem nezůstává ve železném stavu, neztrácí elektron..
Okysličení produkuje změnu ve kvartérní struktuře molekuly, tj. Změnu v konformaci, která může být přenášena z globinových řetězců na hemovou skupinu a naopak..
Jaké je maximální množství kyslíku, které může hemoglobin nést?
Hemoglobin může ve své struktuře nanejvýš vázat čtyři molekuly kyslíku. Je-li molární objem ideálních plynů 22,4 l / mol, naváže se jeden mol hemoglobinu (64 500 g) na 89,6 litru kyslíku (4 moly O2 x 22,4 l / mol).
Každý gram hemoglobinu tedy musí vázat 1,39 ml O2, aby byl 100% nasycen (89,6 l / 64 500 g x (1000 ml / l)).
V praxi poskytují krevní testy mírně nižší výsledky, protože existují malá množství methemoglobinu (oxidovaný hemoglobin) a karboxyhemoglobinu (hemoglobin + oxid uhelnatý (CO)), které nemohou vázat kyslík.
S ohledem na to pravidlo „Hüfner“ stanoví, že v krvi má 1 g hemoglobinu maximální kapacitu vázat kyslík 1,34 ml.
Křivka vazby oxyhemoglobinu
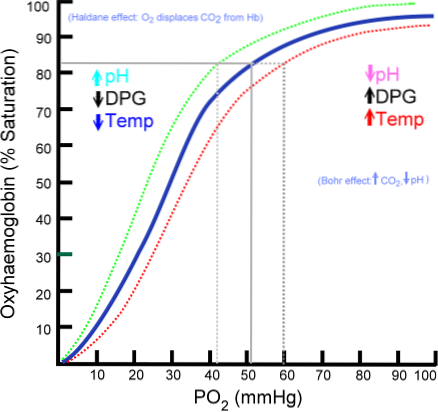
Počet molekul kyslíku, které se mohou vázat na molekulu hemoglobinu, závisí na parciálním tlaku kyslíku nebo PO2. V nepřítomnosti kyslíku je hemoglobin deoxygenován, ale jak se zvyšuje PO2, zvyšuje se počet kyslíků, které se vážou na hemoglobin..
Proces vázání kyslíku na hemoglobin v závislosti na parciálním tlaku kyslíku. Při vykreslení se výsledek nazývá „křivka oxyhemoglobinu“ a má charakteristický tvar „S“ nebo sigmoid..
V závislosti na PO2 bude hemoglobin méně či více schopen „uvolňovat“ nebo „dodávat“ kyslík, který přenáší, a také být jím nabit..
Například v oblasti tlaku mezi 10 a 60 mmHg se získá nejstrmější část křivky. V tomto stavu se hemoglobin může snadno vzdát velkého množství O2. To je stav, kterého je dosaženo v tkáních.
Když je PO2 mezi 90 a 100 mmHg (12 až 13 kPa), hemoglobin je téměř 100% nasycen kyslíkem; a když je arteriální PO2 60 mmHg (8 kPa), saturace O2 je stále až 90%.
V plicích jsou to podmínky, které převládají (tlak mezi 60 a 100 mmHg), a právě ten umožňuje, aby molekuly hemoglobinu přítomné v erytrocytech byly nabity kyslíkem..
Tento sigmoidní tvar, který vykresluje křivku oxyhemoglobinu, zajišťuje, že se tento protein chová jako vynikající plicní zavaděč, velmi účinný transportér v arteriální krvi a vynikající donor O2 v tkáních, v poměru k místní rychlosti metabolismu. Tj. Na vyžádání.
Reference
- Fox, S. I. (2006). Fyziologie člověka 9. vydání (str. 501-502). Tisk McGraw-Hill, New York, USA.
- Murray, R. K., Granner, D. K., Mayes, P. A., & Rodwell, V. W. (2014). Harperova ilustrovaná biochemie. McGraw-Hill.
- Rawn, J. D. (1998). Biochemie (1989). Burlington, Severní Karolína: Neil Patterson Publishers (c) N. Lalioti, CP Raptopoulou, A. Terzis, A. Panagiotopoulos, SP Perlepes, E. Manessi-Zoupa, J. Chem. Soc. Dalton Trans, 1327.
- Robert M. Berne, Matthew N. Levy. (2001) Fyziologie. (3. vyd.) Ediciones Harcourt, S.A..
- West, J. B. (1991). Fyziologické základy lékařské praxe. Williams & Wilkins



Zatím žádné komentáře