
Vlastnosti, rizika a použití peroxidu vápenatého (CaO2)
The peroxid vápenatý, známý také jako oxid vápenatý, je to chemická sloučenina se vzorcem CaOdva. K tomu dochází při interakci rozpouštění soli nebo hydroxidu vápenatého a peroxidu sodného s následnou krystalizací.
Peroxid vápenatý se vyrábí srážením oktahydrátové sloučeniny z vodného roztoku a následnou dehydratací při teplotách nad 100 ° C..
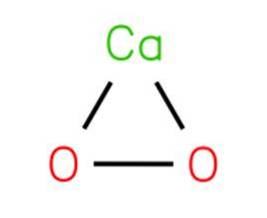
Peroxid vápenatý se při kontaktu s hydratovaným materiálem rozpadá a uvolňuje kyslík. CaOdva je jedním z teplotně nejstabilnějších anorganických peroxidů a ve vlhkém vzduchu se pomalu rozkládá.
Vodná suspenze 1: 100 má pH přibližně 12. Kromě své stabilní schopnosti uvolňovat kyslík, CaOdva Má podobné funkce jako jiné peroxidy: bělení, dezinfekci a dezodoraci. Dále je třeba poznamenat, že CaOdva díky svým vlastnostem respektuje životní prostředí. (Kingsfield Inc, 2011).
Rejstřík článků
- 1 Fyzikální a chemické vlastnosti peroxidu vápenatého
- 2 Reaktivita a nebezpečí
- 3 použití
- 3.1 Použití při sanaci půdy
- 3.2 Jiná použití
- 3.3 Obnova životního prostředí
- 3.4 Průmyslové použití
- 4 Odkazy
Fyzikální a chemické vlastnosti peroxidu vápenatého
Peroxid vápenatý je bílý nebo nažloutlý prášek bez charakteristické aroma nebo chuti (National Center for Biotechnology Information., 2017).

CaOdva má molekulovou hmotnost 72,0768 g / mol a hustotu 2,91 g / ml. Sloučenina má teplotu tání 200 ° C a rozkládá se nad 355 ° C. Je mírně rozpustný ve vodě a tvoří peroxid vodíku. Má pKa 12,5 (Royal Society of Chemistry, 2015).
Peroxid vápenatý představuje nebezpečí výbuchu, pokud je smíchán s jemně rozmělněnou organickou hmotou. Sloučenina není sama o sobě hořlavá, ale spíše urychluje spalování hořlavého materiálu. Je to proto, že směsi hořlavého materiálu a peroxidu se mohou vznítit třením nebo kontaktem s vlhkostí..
Reaktivita a nebezpečí
Peroxid vápenatý, i když je ve srovnání s jinými peroxidy relativně stabilní sloučeninou, je klasifikován jako výbušná sloučenina a silné oxidační činidlo..
Kontakt s peroxidem vápenatým může být velmi dráždivý a může popálit pokožku a oči. Expozice může dráždit oči, nos a hrdlo.
Dlouhodobé vystavení může poškodit pokožku. Vyšší hladiny peroxidu vápenatého mohou dráždit plíce a způsobit kašel nebo dušnost..
Ještě vyšší expozice mohou způsobit hromadění tekutin v plicích (plicní edém), což vede k úmrtí (National Library of Medicine, 2015).
V případě kontaktu s očima je třeba kontaktní čočky zkontrolovat a vyjmout. Poté si oči alespoň 15 minut vyplachujte velkým množstvím studené vody..
V případě kontaktu s pokožkou je třeba postižené místo okamžitě opláchnout velkým množstvím vody po dobu nejméně 15 minut a zároveň odstranit kontaminovaný oděv a obuv. Podrážděnou pokožku zakryjte změkčovadlem. Před opětovným použitím vyperte oblečení a obuv. Při silném kontaktu omyjte dezinfekčním mýdlem a znečištěnou pokožku překryjte antibakteriálním krémem..
V případě vdechnutí by měl být postižený přemístěn na chladné místo. Pokud nedýchá, je poskytováno umělé dýchání.
Pokud je sloučenina požita, vyvolat zvracení, pokud to není nařízeno lékařským personálem. Doporučuje se pít velké množství vody, aby se dosáhlo zředění sloučeniny. Mělo by se uvolnit těsné oblečení, jako je límeček, opasek nebo kravata..
Ve všech případech je třeba okamžitě vyhledat lékařskou pomoc (Bezpečnostní list materiálu Peroxid vápenatý, 2013).
Aplikace
Použití při sanaci půdy
Ze všech způsobů, jak můžete využít peroxid vápenatý, je nejrozšířenější jeho zemědělská aplikace. Skutečnost, že peroxid vápníku uvolňuje kyslík při kontaktu s vodou, znamená, že jej lze použít jako způsob omlazení ochuzené půdy..
Normálně se po intenzivním zemědělství nebo při zaplavení půdy z půdy ztrácejí živiny a kyslík, což ji činí sterilní..
V takovém scénáři musí být k přidání minerálů a živin do půdy použita různá umělá hnojiva a další zásahy, aby byla znovu životaschopná. Peroxid vápníku je pro tento proces nezbytný, protože se používá ke zvýšení obsahu kyslíku v půdě.
Jiná použití
Skutečnost, že peroxid vápenatý může v kombinaci s kyselinami uvolňovat peroxid vodíku, znamená, že jej lze použít jako bělidlo..
Tímto způsobem je široce používán v mnoha papírenských průmyslech. Výroba peroxidu vodíku touto sloučeninou je také užitečná při deodorizaci a bělení vlasových produktů a textilií..
Peroxid vápenatý má své místo také ve zdravotnictví, protože může být použit jako antiseptikum..
Peroxid vápenatý se používá při pečení jako pomocná látka při míchání chlebového těsta. Sloučenina se při kontaktu s vodou rozkládá na kyslík. To oxiduje a posiluje disulfidové a nedisulfidové příčné vazby v lepku..
Obnova životního prostředí
Skutečnost, že peroxid vápenatý může působit jako zdroj kyslíku, znamená, že je užitečný v mnoha ekologických podmínkách..
Například existuje mnoho vodních ploch, jako jsou jezera a rybníky, které se staly neživotaschopnými kvůli znečištění a dalším souvisejícím faktorům..
V takovém scénáři lze použít peroxid vápenatý k omlazení i těchto vodních ploch. Kyslík uvolněný reakcí mezi vodou a sloučeninou obnovuje obsah kyslíku ve vodě.
Průmyslové použití
Úloha peroxidu vápenatého při výrobě plastů je kritická pro procesy katalýzy a zesíťování různých sloučenin, které se používají při polymeraci plastů k jejich tvrdnutí. Peroxid vápenatý se také používá jako iniciátor těchto procesů (Chuangjia Chemical Co, 2011).
Reference
- PEROXID VÁPENATÝ. (2016). Obnoveno z cameochemicals.noaa.gov.
- Peroxid vápenatý. (S.F.). Obnoveno z bakerpedia.com.
- Chuangjia Chemical Co. (2011). Peroxid vápenatý. Obnoveno z chinacjchem.com.
- EMBL-EBI. (2014, 28. července). peroxid vápenatý. Obnoveno z ebi.ac.uk.
- Kingsfield Inc. (2011). Peroxid vápenatý-CALGRO ™. Obnoveno z Kingsfieldinc.
- Bezpečnostní list materiálu Peroxid vápenatý. (2013, 21. května). Obnoveno z sciencelab.com.
- Národní centrum pro biotechnologické informace… (2017, 11. března). Složená databáze PubChem; CID = 14779. Citováno z PubChem.
- Národní lékařská knihovna. (2015, 19. října). PEROXID VÁPENATÝ. Obnovený detoxnet.
- Royal Society of Chemistry. (2015). Dioxid vápenatý. Obnoveno z chemspider.com.


Zatím žádné komentáře