
Struktura, typy a funkce G proteinů
The G proteiny nebo guaninové nukleotidové vazebné proteiny, jsou proteiny spojené s plazmatickou membránou patřící do rodiny signálních „vazebných“ proteinů, které mají důležité funkce v mnoha procesech přenosu signálu v eukaryotických organismech.
V literatuře jsou G proteiny popisovány jako binární molekulární přepínače, protože jejich biologická aktivita je dána změnami jejich struktury danými nukleotidovými druhy, na které jsou schopné se vázat: guanosinové nukleotidy (difosfát (GDP) a trifosfát (GTP) ).
Obecně jsou aktivovány receptory rodiny proteinů známých jako receptory spojené s G proteinem (GPCR).Receptory spojené s G-proteinem "), kteří přijímají externí počáteční signál a převádějí jej na konformační změny, které spouštějí aktivaci, což se následně promítá do aktivace jiného efektorového proteinu.
Někteří autoři se domnívají, že kódující geny pro tuto rodinu proteinů se vyvinuly duplikací a divergencí společného genu předků, jehož produkt byl stále více rafinovaný a specializovaný.
Mezi nejrůznější buněčné funkce, které tyto proteiny mají, patří translokace makromolekul během syntézy proteinů, transdukce hormonálních signálů a senzorických podnětů, jakož i regulace buněčné proliferace a diferenciace..
Byly popsány dvě třídy tohoto typu proteinu: malé G proteiny a heterotrimerické G proteiny. První trojrozměrná struktura G proteinu byla získána před více než deseti lety z malého G proteinu známého jako Ras.
Rejstřík článků
- 1 Struktura
- 2 druhy
- 2.1 Malé G proteiny
- 2.2 Heterotrimerické G proteiny
- 3 funkce
- 3.1 Jak fungují?
- 4 Odkazy
Struktura
Strukturálně vzato jsou rozpoznávány dva typy G proteinů: malé G proteiny a mnohem složitější heterotrimerní G proteiny..
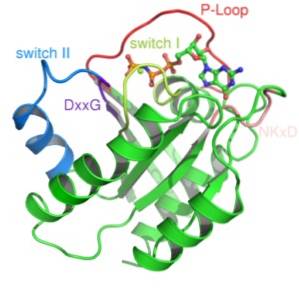
Malé G proteiny jsou tvořeny jediným polypeptidem s asi 200 aminokyselinovými zbytky a asi 20 - 40 kDa a ve své struktuře existuje konzervovaná katalytická doména (doména G) složená z pěti α-helixů, šesti β-přeložených listů a pět polypeptidových smyček.
Heterotrimerické G proteiny, na druhé straně, jsou integrální membránové proteiny, které jsou složeny ze tří polypeptidových řetězců, známých jako podjednotky α, β a γ..
-A podjednotka váží mezi 40 a 52 kDa, má guaninovou nukleotidovou vazebnou oblast a má aktivitu GTPázy k hydrolýze vazeb mezi fosfátovými skupinami GTP..
Α podjednotky různých G proteinů sdílejí některé strukturní domény, jako jsou ty pro vazbu a hydrolýzu GTP, ale jsou velmi odlišné ve svých vazebných místech pro receptor a efektorové proteiny..
-Β podjednotka má mírně nižší molekulovou hmotnost (mezi 35 a 36 kDa).
-Na druhé straně je γ podjednotka mnohem menší a má přibližnou molekulovou hmotnost 8 kDa..
Všechny heterotrimerní G proteiny mají 7 transmembránových domén a sdílejí sekvenční podobnost s doménami β a y. Tyto dvě domény jsou tak silně spojeny, že se na ně pohlíží jako na jednu funkční jednotku..
Typy
Jak bylo uvedeno výše, existují dva typy G proteinů: malé a heterotrimerické..
Malé G proteiny mají roli v buněčném růstu, sekreci proteinů a v interakci intracelulárních vezikul. Heterotrimerické G proteiny jsou spojeny s transdukcí signálů z povrchových receptorů a působí také jako přepínače, které se střídají mezi dvěma stavy v závislosti na přidruženém nukleotidu..
Malé G proteiny
Tyto proteiny se také nazývají malé GTPasy, malé proteiny vázající GTP nebo nadrodina proteinů Ras a tvoří samostatnou nadrodinu ve velké třídě GTP hydroláz s regulačními funkcemi..
Tyto proteiny jsou velmi rozmanité a řídí více buněčných procesů. Vyznačují se konzervovanou doménou vázající GTP, doménou „G“. Vazba tohoto fosfátového nukleotidu způsobuje důležité konformační změny v jeho katalytické doméně v malých G proteinech..
Jeho aktivita úzce souvisí s proteiny aktivujícími GTPázu (GAP).Protein aktivující GTPázu ") a s guaninovými nukleotidovými výměnnými faktory (GEF)Guanine Nucleotide Exchange Factor ”).
U eukaryot bylo popsáno pět tříd nebo rodin malých G proteinů:
-Ras
-Rho
-Rab
-Sar1 / Arf
-Běžel
Proteiny Ras a Rho řídí expresi genu a proteiny Rho také modulují reorganizaci cytoskeletu. Proteiny skupiny Rab a Sar1 / Arf ovlivňují vezikulární transport a proteiny Ran regulují jaderný transport a buněčný cyklus..
Heterotrimerické G proteiny
Tento typ proteinu si také zaslouží asociaci s dalšími dvěma proteinovými faktory, takže signální dráha z vnějšího prostředí do vnitřku buňky je tvořena třemi prvky v následujícím pořadí:
- The spojené přijímače na G proteiny
- The G proteiny
- The protein nebo efektorové kanály
Existuje velká rozmanitost heterotrimerních G proteinů a to souvisí s velkou rozmanitostí alfa podjednotek, které existují v přírodě, ve kterých je konzervováno pouze 20% aminokyselinové sekvence.
Heterotrimerické G proteiny jsou obvykle identifikovány díky rozmanitosti α podjednotky, založené hlavně na jejich funkčních a sekvenčních podobnostech..
Podjednotky α jsou tvořeny čtyřmi rodinami (rodina Gs, rodina Gi / o, rodina Gq a rodina G12). Každá rodina je tvořena jiným „izotypem“, který společně přidává více než 15 různých forem podjednotek α..
Rodina G.s
Tato rodina obsahuje zástupce, kteří se také podílejí na regulaci proteinů adenylátcyklázy a je exprimována ve většině buněčných typů. Skládá se ze dvou členů: Gs a Golf.
Dolní index „s " označuje stimulaci (z anglického „stimulace ") a dolní index „olf " odkazuje na "vůni" (z angličtiny "Čichání"). Golfové proteiny jsou zvláště exprimovány ve smyslových neuronech odpovědných za vůni.
Rodina G.i / o
Jedná se o největší a nejrozmanitější rodinu. Jsou exprimovány v mnoha buněčných typech a zprostředkovávají na receptorech závislou inhibici různých typů adenylcykláz (dolní index „já " označuje inhibici).
Proteiny s podjednotkami α skupiny Go jsou zvláště exprimovány v buňkách centrálního nervového systému a mají dvě varianty: A a B..
Rodina G.co
Za regulaci fosfolipázy C jsou zodpovědné proteiny s touto rodinou α-podjednotek. Tato rodina se skládá ze čtyř členů, jejichž α-podjednotky jsou exprimovány různými geny. Jsou bohaté na jaterní buňky, ledvinové buňky a plíce.
Rodina G.12
Tato rodina je všudypřítomně exprimována v organismech a není s jistotou známo, jaké přesně jsou buněčné procesy regulované prostřednictvím proteinů s těmito podjednotkami..
Β a γ podjednotky
Ačkoli je pro identifikaci heterotrimerických proteinů rozhodující rozmanitost alfa struktur, existuje také velká rozmanitost s ohledem na další dvě podjednotky: beta a gama..
Funkce
G proteiny se účastní „směrování“ signálů z receptorů na plazmatické membráně do kanálů nebo efektorových enzymů..
Nejběžnějším příkladem funkce tohoto typu proteinu je regulace enzymu adenylátcyklázy, enzymu odpovědného za syntézu adenosin 3 ', 5'-monofosfátu nebo jednoduše cyklického AMP, molekuly, která má důležité funkce jako druhý posel v mnoha známých buněčných procesech:
-Selektivní fosforylace proteinů se specifickými funkcemi
-Genetická transkripce
-Cytoskeletální reorganizace
-Vylučování
-Membránová depolarizace
Rovněž se nepřímo podílejí na regulaci signální kaskády inositolu (fosfatidylinositol a jeho fosforylované deriváty), které jsou odpovědné za řízení procesů závislých na vápníku, jako je chemotaxe a sekrece rozpustných faktorů..
Mnoho iontových kanálů a transportních proteinů je přímo řízeno proteiny z rodiny proteinů G. Stejným způsobem jsou tyto proteiny zapojeny do mnoha senzorických procesů, jako je vidění, čich, mimo jiné..
Jak fungují?
Způsob interakce G proteinu s efektorovými proteiny je specifický pro každou třídu nebo rodinu proteinů.
U G proteinů spojených s membránovými receptory (heterotrimerní G proteiny) navázání guaninového nukleotidu, jako je GDP nebo guanosindifosfát, na α podjednotku, způsobí asociaci tří podjednotek a vytvoří komplex známý jako Gαβγ nebo G-GDP, což je připojené k membráně.
Pokud je molekula GDP následně vyměněna za molekulu GTP, α podjednotka připojená k GTP disociuje z podjednotek β a γ a vytvoří samostatný komplex známý jako Gα-GTP, který je schopen změnit aktivitu svých enzymů nebo cílových nosných proteinů.
Hydrolytická aktivita této podjednotky umožňuje ukončit aktivaci, vyměnit GTP za nový GDP a přejít do neaktivní konformace..
Při absenci excitovaných receptorů, které se sdružují s G proteiny, je tento proces výměny GDP na GTP velmi pomalý, což znamená, že heterotrimerní G proteiny směňují GDP za GTP pouze fyziologicky významnou rychlostí, když jsou vázány na své excitované receptory.
Reference
- Gilman, G. (1987). G proteiny: převodníky signálů generovaných receptory. Roční recenze v biochemii, 56, 615-649.
- Milligan, G. a Kostenis, E. (2006). Heterotrimerní G-proteiny: krátká historie. British Journal of Pharmacology, 147, 546-555.
- Offermanns, S. (2003). G-proteiny jako snímače v transmembránové signalizaci. Pokrok v biofyzice a molekulární biologii, 83, 101-130.
- Simon, M., Strathmann, M. P. a Gautam, N. (1991). Rozmanitost proteinů G v transdukci signálu. Věda, 252, 802-808.
- Syrovatkina, V., Alegre, K. O., Dey, R. a Huang, X. (2016). Regulace, signalizace a fyziologické funkce G-proteinů. Journal of Molecular Biology, 428(19), 3850-3868.



Zatím žádné komentáře