
Co je volatilizace?

The volatilizace je proces přeměny chemické látky z kapalného nebo pevného stavu na plynný nebo parní stav. Dalšími pojmy používanými k popisu stejného procesu jsou odpařování, destilace a sublimace..
Jedna látka může být často oddělena od druhé těkáním a poté může být získána kondenzací par..

Látka může být rychleji těkavá buď zahřátím ke zvýšení tlaku par, nebo odstraněním páry pomocí proudu inertního plynu nebo vakuové pumpy..
Postupy zahřívání zahrnují těkání vody, rtuti nebo chloridu arzenitého, aby se tyto látky oddělily od interferujících prvků..
Chemické reakce se někdy používají k výrobě těkavých produktů, například při uvolňování oxidu uhličitého z uhličitanů, amoniaku v Kjeldahlově metodě pro stanovení dusíku a oxidu siřičitého při stanovení síry v oceli.
Metody těkání se obecně vyznačují velkou jednoduchostí a snadnou obsluhou, kromě případů, kdy jsou zapotřebí vysoké teploty nebo materiály vysoce odolné proti korozi (Louis Gordon, 2014).
Odpařování tlaku par
Věděli jste, že teplota varu vody je 100 ° C, přemýšleli jste někdy o tom, proč se dešťová voda odpařuje??
Je 100 ° C? Pokud ano, proč se neohřeju? Přemýšleli jste někdy nad tím, co dodává charakteristické aroma alkoholu, octu, dřevu nebo plastu? (Tlak par, S.F.)
Za to všechno je zodpovědná vlastnost známá jako tlak par, což je tlak vyvíjený párou v rovnováze s pevnou nebo kapalnou fází stejné látky..
Rovněž parciální tlak látky v atmosféře na pevnou nebo kapalnou látku (Anne Marie Helmenstine, 2014).
Tlak páry je míra tendence materiálu ke změně do plynného nebo parního stavu, tj. Míra těkavosti látek.
Jak se zvyšuje tlak par, tím větší je schopnost odpařovat kapalinu nebo pevnou látku, čímž je těkavější..
Tlak páry se bude s teplotou zvyšovat. Teplota, při které se tlak par na povrchu kapaliny rovná tlaku vyvíjenému prostředím, se nazývá bod varu kapaliny (Encyclopædia Britannica, 2017).
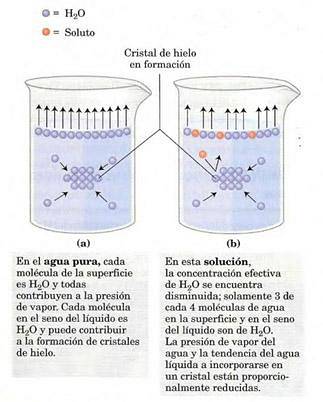
Tlak par bude záviset na rozpuštěné látce v roztoku (jedná se o koligativní vlastnost). Na povrchu roztoku (rozhraní vzduch-plyn) mají nejpovrchnější molekuly tendenci se odpařovat, vyměňovat se mezi fázemi a vytvářet tlak par..
Přítomnost rozpuštěné látky snižuje počet molekul rozpouštědla na rozhraní a snižuje tlak par..
Změnu tlaku par lze vypočítat podle Raoultova zákona pro netěkavé látky, který je dán vztahem:
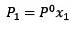
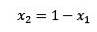
Kde X2 je molární zlomek rozpouštědla. Pokud vynásobíme obě strany rovnice P °, pak zůstane:
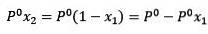
Nahrazení (1) v (3) je:
(4)
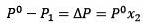
Jedná se o změnu tlaku par při rozpouštění rozpuštěné látky (Jim Clark, 2017).
Gravimetrická analýza
Gravimetrická analýza je třída laboratorních technik používaných ke stanovení hmotnosti nebo koncentrace látky měřením změny hmotnosti..
Chemická látka, kterou se snažíme kvantifikovat, se někdy nazývá analyt. Mohli bychom použít gravimetrickou analýzu k zodpovězení otázek, jako jsou:
- Jaká je koncentrace analytu v roztoku?
- Jak čistý je náš vzorek? Vzorek zde může být pevný nebo v roztoku.
Existují dva běžné typy gravimetrické analýzy. Oba zahrnují změnu fáze analytu, aby se oddělil od zbytku směsi, což vede ke změně hmotnosti..
Jednou z těchto metod je srážková gravimetrie, ale ta, která nás opravdu zajímá, je těkavá gravimetrie.
Volatilizační gravimetrie je založena na tepelném nebo chemickém rozkladu vzorku a měření výsledné změny jeho hmotnosti..
Alternativně můžeme zachytit a zvážit těkavý produkt rozkladu. Protože uvolňování těkavých druhů je podstatnou součástí těchto metod, souhrnně je klasifikujeme jako metody těkavé gravimetrické analýzy (Harvey, 2016).
Problémy s gravimetrickou analýzou jsou jednoduše problémy se stechiometrií s několika dalšími kroky.
K provedení jakéhokoli stechiometrického výpočtu potřebujeme koeficienty vyvážené chemické rovnice.
Například pokud vzorek obsahuje dihydrát chloridu barnatého (BaCldva● HdvaO), množství nečistot lze získat zahřátím vzorku k odpaření vody.
Rozdíl v hmotnosti mezi původním a zahřátým vzorkem nám dá v gramech množství vody obsažené v chloridu barnatém.
Jednoduchým stechiometrickým výpočtem bude získáno množství nečistot ve vzorku (Khan, 2009).
Frakční destilace
Frakční destilace je proces, při kterém se složky kapalné směsi dělí na různé části (nazývané frakce) podle jejich různých bodů varu.
Rozdíl v těkavostech sloučenin ve směsi hraje zásadní roli v jejich separaci..
Frakční destilace se používá k čištění chemikálií a také k separaci směsí za účelem získání jejich složek. Používá se jako laboratorní technika a v průmyslu, kde má tento proces velký komerční význam.
Páry z vroucího roztoku procházejí vysokou kolonou, která se nazývá frakční kolona..
Kolona je naplněna plastovými nebo skleněnými kuličkami, aby se zlepšilo oddělení zajištěním většího povrchu pro kondenzaci a odpařování.
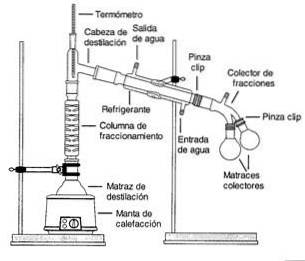
Teplota kolony se po její délce postupně snižuje. Složky s vyšším bodem varu kondenzují v koloně a vracejí se k roztoku.
Složky s nižšími body varu (těkavější) procházejí kolonou a shromažďují se v horní části.
Teoreticky má více perliček nebo destiček zlepšení separace, ale přidání destiček také zvyšuje čas a energii potřebnou k dokončení destilace (Helmenstine, 2016)..
Reference
- Anne Marie Helmenstine. (2014, 16. května). Definice tlaku par. Obnoveno z thoughtco.com.
- Encyklopedie Britannica. (2017, 10. února). Tlak páry. Obnoveno z britannica.com.
- Harvey, D. (2016, 25. března). Volatilizační gravimetrie. Obnoveno z chem.libretexts.
- Helmenstine, A. M. (2016, 8. listopadu). Definice a příklady frakční destilace. Obnoveno z thoughtco.com.
- Jim Clark, I.L. (2017, 3. března). Raoultův zákon. Obnoveno z chem.libretexts.
- Khan, S. (2009, 27. srpna). Úvod do gravimetrické analýzy: Volatilizační gravimetrie. Obnoveno z khanacademy.
- Louis Gordon, R. W. (2014). Obnoveno z accessscience.com.
- Tlak páry. (S.F.). Obnoveno z chem.purdue.edu.



Zatím žádné komentáře