
Co jsou Döbereinerovy triády?

The Döbereinerovy triády Jsou to skupiny tří chemických prvků, které mají podobné vlastnosti. Jsou součástí 118 chemických prvků, které jsou rozmanitostí zobrazených reakcí a jejich sloučenin, jejich nejfascinujícím aspektem.
Myšlenkou klasifikace prvků je adekvátně ošetřit jejich chemické vlastnosti, aniž by bylo nutné vyvíjet soubor pravidel a teorií pro každý z nich izolovaně..
Jejich periodická klasifikace poskytla nesmírně užitečný systematický rámec pro jejich korelaci podle několika velmi jednoduchých a logických vzorců..
Prvky jsou systematicky uspořádány do řádků a sloupců se zvyšujícím se počtem atomů a pro nové objevy byl vyhrazen prostor..
V roce 1815 bylo známo jen asi 30 položek. Ačkoli o těchto a jejich sloučeninách bylo k dispozici spousta informací, nebylo zjevné pořadí.
Bylo učiněno několik pokusů o nalezení řádu, nicméně bylo obtížné zorganizovat vše, co bylo známo, takže mnoho vědců začalo hledat nějaké vzorce ve svých vlastnostech, které by umožnily napravit tuto situaci..
Objev trojice Döbereinerů
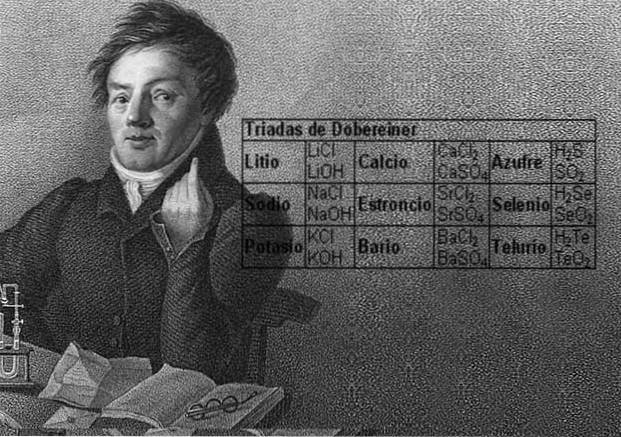
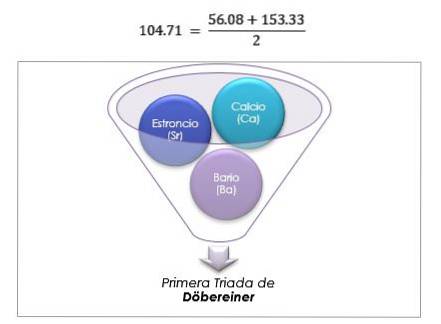
Vědec Johann Wolfgang Döbereiner učinil důležitá zjištění o numerické pravidelnosti mezi atomovými hmotnostmi prvků, jako první si všiml existence několika skupin tří prvků, které nazval triády, které vykazovaly chemické podobnosti.
Tyto prvky odhalily důležitý numerický vztah, protože jakmile byly uspořádány podle jejich ekvivalentní hmotnosti nebo atomové hmotnosti, ukázalo se, že hmotnost centrálního prvku je přibližným průměrem dvou zbývajících prvků v triádě..
V roce 1817 Döbereiner zjistil, že pokud jsou určité prvky kombinovány s kyslíkem v binárních sloučeninách, lze rozlišit numerický vztah mezi ekvivalentními hmotnostmi těchto sloučenin.
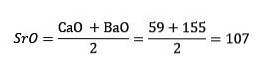
Döbereinerovo pozorování mělo zpočátku malý dopad na chemický svět, ale později se stalo velmi vlivným. Dnes je považován za jednoho z průkopníků ve vývoji periodického systému..
O dvanáct let později, v roce 1829, Döbereiner přidal tři nové triády, které jsou uvedeny níže:
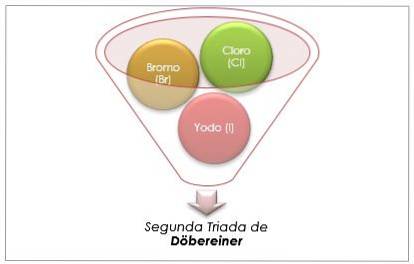
Halogenová skupina
Chlor, brom a jod mají podobné chemické vlastnosti a tvoří triádu. Tyto prvky jsou vysoce reaktivní nekovy. Pokud jsou uvedeny v pořadí podle zvyšující se relativní hmotnosti, jsou v pořadí podle klesající reaktivity. Brom má střední atomovou hmotnost mezi chlorem a jodem.

Atomová hmotnost prostředního prvku Brom (Br) se rovná průměru atomových hmotností chloru (Cl) a jodu (I).
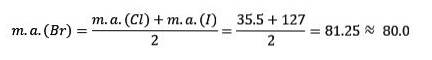
Získaná průměrná hodnota se blíží atomové hmotnosti bromu (Br).
Podobnosti v chemických vlastnostech:
- Všichni jsou nekovy.
- Všechny reagují s vodou za vzniku kyselin (například v: HCl, HBr, HF).
- Všechny mají valenci jedné (například v: HCl, HBr, HF).
- Všechny reagují s alkalickými kovy za vzniku neutrálních solí (např. NaCl, NaBr, NaI)
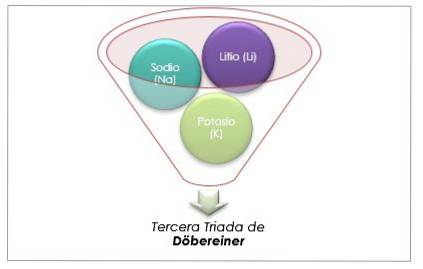
Skupina alkalických kovů
Lithium, sodík a draslík mají podobné chemické vlastnosti a tvoří triádu. Tyto prvky jsou měkké a lehké kovy, ale velmi reaktivní..
Pokud jsou uvedeny v pořadí zvyšování relativní atomové hmotnosti, jsou také v pořadí zvyšování reaktivity. Sodík má střední atomovou hmotnost mezi lithiem a draslíkem.

Atomová hmotnost centrálního prvku Sodík (Na) se rovná průměru atomové hmotnosti lithia (Li) a draslíku (K).
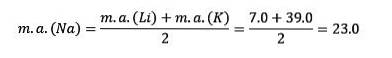
Podobnosti v chemických vlastnostech:
- Jsou to všechno kovy.
- Všichni reagují s vodou za vzniku alkalických roztoků a plynného vodíku..
- Všechny mají valenci jedné (například v: LiCl, NaCl, KCl).
- Jeho uhličitany jsou odolné vůči tepelnému rozkladu.
Skupina chalkogenů nebo amfigenů
Síra, selen a tellur mají podobné chemické vlastnosti a tvoří triádu. Selen má střední atomovou hmotnost mezi sírou a telurem.

Atomová hmotnost středního prvku selenu (Se) se rovná průměrné atomové hmotnosti síry (S) a teluru (Te).
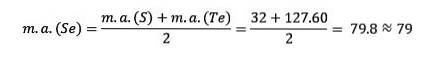
Získaná průměrná hodnota se opět blíží atomové hmotnosti selenu (Se).
Podobnosti v chemických vlastnostech:
- Vodíkové kombinace těchto prvků vedou k toxickým plynům.
- Každý z těchto prvků má 6 valenčních elektronů.
- Kovové vlastnosti se zvyšují s rostoucím atomovým číslem.

Döbereiner také poznamenal, že triády musí odhalit chemické vztahy mezi prvky i numerické vztahy, aby byly platné..
Na druhou stranu odmítl seskupovat fluor společně s chlorem, bromem a jodem, jak to mohl udělat z chemických důvodů, protože nenalezl triadický vztah mezi atomovými hmotnostmi fluoru a hmotností těchto ostatních halogenů..
Rovněž se zdráhal uvažovat o vzhledu triád mezi odlišnými prvky, jako je dusík, uhlík a kyslík, a to navzdory skutečnosti, že vykazovaly významný trojitý numerický vztah.
Dobereinerova práce se zaměřila na vztahy mezi prvky triády, ale neposkytla žádné vodítko o vztahu mezi triády..
Stačí říci, že Döbereinerův výzkum stanovil pojem triád jako mocného konceptu, který brzy zohlední několik dalších chemiků..
Ve skutečnosti Döbereinerovy triády představovaly první krok ke seskupení prvků do vertikálních sloupců v periodické tabulce a tímto způsobem vytvořily systém, který vysvětluje chemické vlastnosti a odhaluje fyzikální vztahy prvků..
Rozšíření triád
Ostatní chemici rozšířili Döbereinerovy triády o více než tři původní prvky. Například byl do horní části triády obsahující chlor, brom a jod přidán fluor..
Byly vyrobeny další „triády“, jako například ten, který obsahoval kyslík, síru, selen a telur. Neexistoval však žádný systém, který by je koreloval jako celek.
Jednou z hlavních nevýhod bylo, že mnoho relativních atomových hmot se v té době stále mýlilo..
Reference
- Clugston, M. a Flemming, R. (2000). Advanced Chemistry. New York, Oxford University Press.
- Johann Wolfgang Döbereiner. Obnoveno z: britannica.com.
- Sauders, N. (2010). Průlomy ve vědě a technologii: Kdo vynalezl periodickou tabulku? Minnesotta, Arcturus Publishing Limited.
- Scerri, E. (2007). Periodická tabulka: její příběh a její význam. New York, Oxford University Press.
- Shyamal, A. (2008). Living Science Chemistry 10. New Delhi, Ratna Sagar P. Ltd.
- Co je skupina 16 periodické tabulky? Jak se tyto prvky používají? Obnoveno z: quora.com.



Zatím žádné komentáře