
Co jsou to diatomické prvky? (Příklady)
The diatomické prvky, Také se nazývají homonukleární diatomické molekuly, jsou tvořeny pouze dvěma atomy stejných chemických prvků. Některé prvky nemohou existovat samy o sobě, i když jsou izolovány od jakéhokoli jiného typu atomu.
Prvky této povahy se spojí s atomy stejného prvku, aby byly stabilní. Jinými slovy, vodík, diatomický prvek, nemůže být sám o sobě. Nemůže jednoduše existovat H.
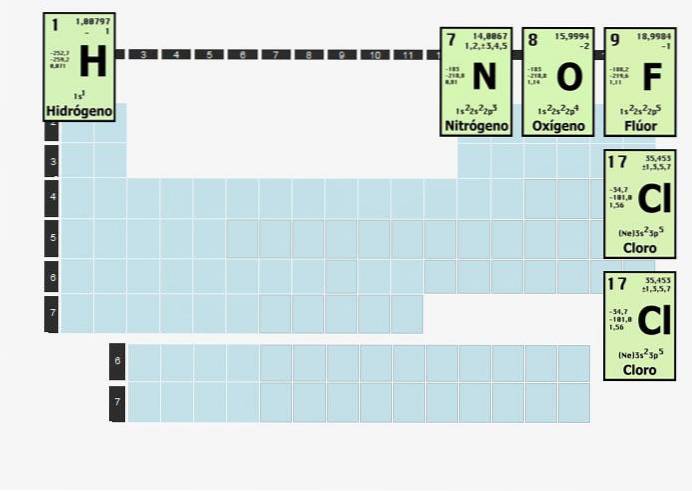
Vodík je tak reaktivní, že když je izolován od všeho kromě vodíku, spojí se do dvouatomové (dvouatomové) molekuly. Plynný vodík, který se někdy používá jako palivo, tedy existuje jako Hdva.
Diatomické molekuly
Diatomické molekuly obsahují dva atomy, které jsou chemicky vázané. Pokud jsou dva atomy identické, například molekula kyslíku (Odva), tvoří homonukleární diatomickou molekulu, zatímco pokud jsou atomy odlišné, jako v molekule oxidu uhelnatého (CO), tvoří heteronukleární diatomickou molekulu.
Molekuly, které obsahují více než dva atomy, se nazývají polyatomové molekuly, například oxid uhličitý (COdva) a voda (HdvaNEBO). Polymerní molekuly mohou obsahovat mnoho tisíc atomů komponent.
Existuje sedm prvků, které tvoří diatomické molekuly. Následující 5 elementárních plynů se při pokojové teplotě a tlaku nachází jako rozsivkové molekuly:
-Vodík - Hdva
-Dusík - Ndva
-Kyslík - O.dva
-Fluorid - Fdva
-Chlor - Cldva
Brom a jód běžně existují v kapalné formě, ale také jako diatomické plyny při mírně vyšších teplotách, což tvoří celkem 7 diatomických prvků..
-Brom - Brdva
-Jód - jádva
Diatomické prvky jsou halogeny (fluor, chlor, brom, jod) a prvky s -genovým zakončením (vodík, kyslík, dusík). Astatin je další halogen, ale jeho chování není známo..
Vlastnosti rozsivkových prvků
Všechny diatomické molekuly jsou lineární, což je nejjednodušší prostorové uspořádání atomů.
Je vhodné a běžné reprezentovat rozsivkovou molekulu jako dvě bodové hmoty (dva atomy) spojené nehmotnou pružinou..
Energie podílející se na pohybech molekuly lze rozdělit do tří kategorií:
- Translační energie (molekula, která se pohybuje z bodu A do bodu B)
- Rotační energie (molekula rotující kolem své osy)
- Vibrační energie (molekuly, které vibrují různými způsoby)
Všechny diatomické prvky jsou plyny při pokojové teplotě, s výjimkou bromu a jodu, které jsou kapalné (jód může být dokonce v pevném stavu) a všechny, s výjimkou kyslíku a dusíku, jsou spojeny jednoduchou vazbou..
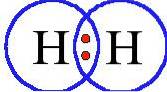
Molekula kyslíku má dva atomy spojené dvojnou vazbou a molekula dusíku trojnou vazbou.
Některé diatomické prvky
Vodík
Vodík (H.dva), s atomovým číslem 1, je bezbarvý plyn, který nebyl formálně objeven jako prvek Henrym Cavendishem až do roku 1766, ale byl náhodně nalezen asi o sto let dříve Robertem Boylem.
Je to bezbarvý netoxický plyn bez zápachu, který přirozeně existuje v našem vesmíru. Jako první prvek v periodické tabulce je vodík nejlehčí a nejhojnější ze všech chemických prvků ve vesmíru, protože tvoří 75% jeho hmotnosti..
Dusík
Dusík (Ndva) má atomové číslo sedm a tvoří asi 78,05% objemové zemské atmosféry.
Je to bez zápachu, bezbarvý a většinou inertní plyn a v kapalném stavu zůstává bezbarvý a bez zápachu..

Kyslík
Kyslík (Odva) má atomové číslo osm. Tento bezbarvý plyn bez zápachu má v jádru osm protonů a je světle modrý v kapalném a pevném stavu..
Jedna pětina zemské atmosféry je tvořena kyslíkem a je to hmotnostně třetí nejhojnější prvek ve vesmíru..
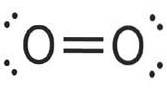
Kyslík je nejhojnější hmotný prvek v zemské biosféře. Vysoká koncentrace kyslíku v atmosféře je výsledkem kyslíkového cyklu Země, který je převážně poháněn fotosyntézou v rostlinách..
Fluor
Fluor (F.dva) má atomové číslo devět a je nejreaktivnějším a elektronegativním ze všech prvků. Tento nekovový prvek je světle žlutý plyn, který je členem halogenové skupiny.
George Gore byl zjevně prvním vědcem, který izoloval fluor, ale jeho experiment explodoval, když produkovaný fluor reagoval s vodíkem..
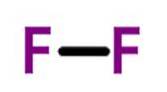
V roce 1906 získal Ferdinand Frederic Henri Moissan Nobelovu cenu za chemii za práci na izolaci fluoru v roce 1886. Jedná se o nejvíce elektronegativní prvek periodické tabulky..
Chlór
Chlor (Cldva) je členem halogenové skupiny s atomovým číslem sedmnáct. Jedna z jeho forem, NaCl, se používá od starověku.

Chlor se používá po tisíce let v mnoha jiných formách, ale až do roku 1810 jej pojmenoval sir Humphry Davy..
Chlor v čisté formě je žlutozelený, ale jeho běžné sloučeniny jsou obvykle bezbarvé..
Bróm
Brom (Brdva) má atomové číslo třicet pět. Je to těžká tmavě hnědá kapalina, jediný nekovový prvek, kterým je kapalina.

Brom objevil Antoine J. Balard v roce 1826. Byl používán k důležitým účelům dlouho předtím, než byl formálně objeven..
Jód
Jód (Idva) má atomové číslo padesát tři, s padesáti třemi protony v jádru atomu. Je to modročerný nekov, který hraje v organické chemii velmi důležitou roli..
Jód objevil v roce 1811 Barnard Courtois. Pojmenoval jej jódem z řeckého slova „jodes“, což znamená fialová. Je to pevná modročerná.
Jód hraje velmi důležitou roli v biologii všech živých organismů, protože jeho nedostatek vede k chorobám, jako je hypertyreóza a hypotyreóza.
Reference
- (S.F.). Homonukleární dvouiatomové molekuly. Obnoveno z boundless.com.
- Chlórová fakta. (S.F.). Obnoveno z softschools.com.
- Diatomické prvky. (S.F.). Obnoveno z ths.talawanda.org.
- Encyklopedie Britannica. (2016, 14. září). Molekula. Obnoveno z britannica.com.
- Helmenstine, A. (2014, 28. září). Diatomické prvky. Obnoveno ze sciencenotes.org.
- Helmenstine, A. M. (2017, 29. března). Co je sedm diatomických prvků? Obnoveno z thoughtco.com.
- Fakta o kyslíku. (S.F.). Obnoveno z softschools.com.
- Royal Society of Chemistry. (2015). molekulární jód. Obnoveno z chemspider.com.



Zatím žádné komentáře