
Hundovo pravidlo nebo princip maximální multiplicity
The Hundovo pravidlo nebo princip maximální multiplicity empiricky stanoví, jak musí energicky zdegenerované orbitální elektrony obsazovat. Toto pravidlo, jak již název napovídá, pochází od německého fyzika Friedricha Hunda v roce 1927 a od té doby je velmi užitečné v kvantové a spektroskopické chemii..
V kvantové chemii platí opravdu tři Hundova pravidla; První je však nejjednodušší pro základní pochopení toho, jak elektronicky strukturovat atom.
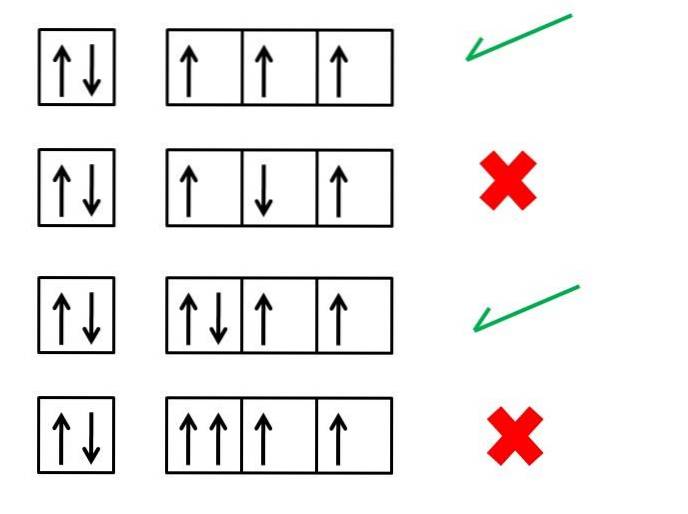
Hundovo první pravidlo, pravidlo maximální multiplicity, je nezbytné pro pochopení elektronických konfigurací prvků; stanoví, jaké by mělo být uspořádání elektronů na orbitálech pro generování atomu (iontu nebo molekuly) s větší stabilitou.
Například výše uvedený obrázek ukazuje čtyři řady elektronových konfigurací; pole představují orbitaly a černé šipky představují elektrony.
První a třetí řada odpovídají správným způsobům uspořádání elektronů, zatímco druhá a čtvrtá řada ukazují, jak by neměly být elektrony umístěny na orbitaly.
Rejstřík článků
- 1 Pořadí vyplňování orbitalů podle Hundova pravidla
- 1.1 Párování otočení
- 1.2 Paralelní a antiparalelní otočení
- 2 Násobnost
- 3 cvičení
- 3.1 Fluor
- 3.2 Titan
- 3.3 Železo
- 4 Odkazy
Objednávka orbitálního plnění podle Hundova pravidla
Ačkoli není zmínka o dalších dvou pravidlech Hunda, správné provedení pořadí plnění implicitně aplikuje tato tři pravidla současně.
Co mají první a třetí série orbitalů společného? Proč jsou správné? Pro začátečníky může každý orbitál „obsahovat“ pouze dva elektrony, a proto je první pole kompletní. Výplň proto musí pokračovat třemi políčky nebo orbitály vpravo.
Spin páření
Každá krabička v první sérii má šipku směřující nahoru, která symbolizuje tři elektrony s rotacemi ve stejném směru. Když směřuje nahoru, znamená to, že jejich otočení mají hodnotu +1/2, a pokud směřují dolů, jejich otočení budou mít hodnoty -1/2.
Všimněte si, že tři elektrony zabírají různé orbitaly, ale s nepárové otočení.
Ve třetí sérii je šestý elektron umístěn s rotací v opačném směru, -1/2. To neplatí pro čtvrtou sérii, kde tento elektron vstupuje do orbitálu s rotací +1/2.
A tak budou mít dva elektrony, jako ty na první oběžné dráze, své párovaná otočení (jeden s rotací +1/2 a druhý s rotací -1/2).
Čtvrtá řada krabic nebo orbitalů porušuje Pauliho vylučovací princip, podle kterého žádný elektron nemůže mít stejná čtyři kvantová čísla. Hundovo pravidlo a Pauliho princip vyloučení jdou vždy ruku v ruce.
Proto by šipky měly být umístěny takovým způsobem, aby byly nepárové, dokud neobsadí všechny krabice; a ihned poté jsou doplněny šipkami směřujícími v opačném směru.
Paralelní a antiparalelní točení
Nestačí, že elektrony mají spiny spárované: musí být také paralelní. To je v reprezentaci polí a šipek zaručeno tím, že tyto konce umístíte svými konci rovnoběžně k sobě..
Druhá řada představuje chybu, že elektron ve třetím poli splňuje svůj spin v antiparalelním smyslu s ohledem na ostatní..
Lze tedy shrnout, že základní stav atomu je takový, který se řídí Hundovými pravidly, a má tedy nejstabilnější elektronovou strukturu.
Teoretická a experimentální podstata potvrzuje, že když má atom elektrony s větším počtem nepárových a paralelních otáčení, stabilizuje se v důsledku zvýšení elektrostatických interakcí mezi jádrem a elektrony; zvýšení, které je způsobeno snížením efektu stínění.
Násobnost
Slovo „multiplicita“ bylo zmíněno na začátku, ale co to v této souvislosti znamená? První Hundovo pravidlo stanoví, že nejstabilnějším základním stavem pro atom je ten s nejvyšším počtem multiplicity spinů; jinými slovy ten se svými orbitaly s nejvyšším počtem nepárových elektronů.
Vzorec pro výpočet multiplicity rotace je
2S + 1
Kde S se rovná počtu nepárových elektronů vynásobenému 1/2. Mít tedy několik elektronických struktur se stejným počtem elektronů, lze odhadnout 2S + 1 pro každý z nich a ten s nejvyšší hodnotou multiplicity bude nejstabilnější..
Multiplicitu spinů lze vypočítat pro první sérii orbitalů se třemi elektrony s jejich rotacemi bezkonkurenčními a paralelními:
S = 3 (1/2) = 3/2
A multiplicita pak je
2 (3/2) + 1 = 4
Toto je Hundovo první pravidlo. Nejstabilnější konfigurace musí také vyhovovat dalším parametrům, které však pro účely chemického porozumění nejsou zcela nezbytné..
Výcvik
Fluor
Uvažuje se pouze o valenčním plášti, protože se předpokládá, že vnitřní plášť je již naplněn elektrony. Elektronová konfigurace fluoru je proto [He] 2sdva2 str5.
Nejprve musí být vyplněn jeden 2s orbitál a poté tři p orbitaly. Chcete-li naplnit 2s orbitál dvěma elektrony, stačí je umístit takovým způsobem, aby jejich spiny byly spárovány.
Dalších pět elektronů pro tři orbitály 2p je uspořádáno, jak je znázorněno níže.
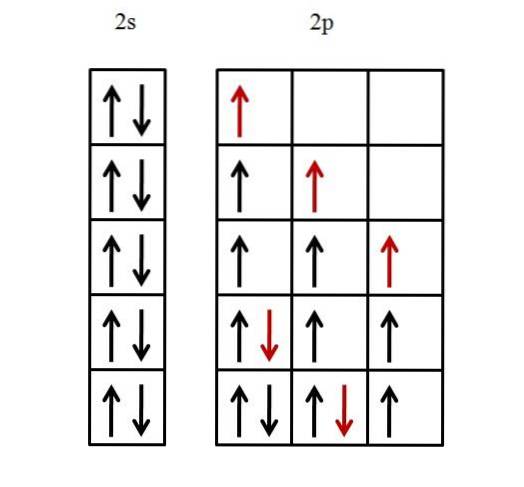
Červená šipka představuje poslední elektron, který vyplňuje orbitaly. Všimněte si, že první tři elektrony, které vstupují do 2p orbitalů, jsou umístěny nepárové a se svými rotacemi rovnoběžnými.
Poté od čtvrtého elektronu začne párovat svůj spin -1/2 s druhým elektronem. Pátý a poslední elektron postupují stejným způsobem.
Titan
Elektronová konfigurace titanu je [Ar] 3ddva4 sdva. Protože existuje pět d orbitalů, doporučuje se začít na levé straně:
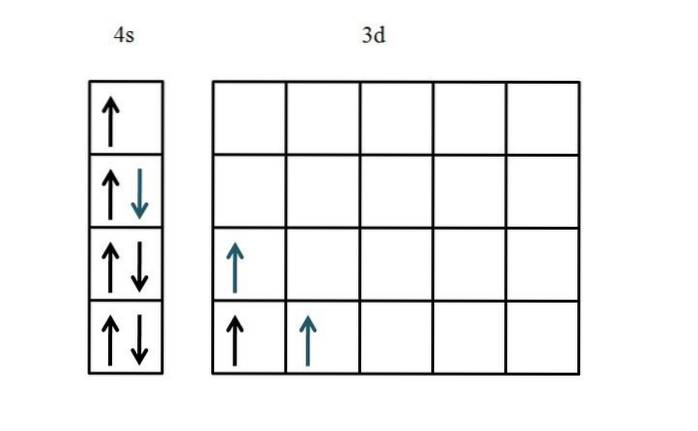
Tentokrát bylo ukázáno plnění orbitálu 4s. Jelikož na 3d orbitálech jsou pouze dva elektrony, není téměř žádný problém nebo zmatek při jejich umístění s nepárovými a paralelními spiny (modré šipky).
Žehlička
Dalším příkladem je železo, kov, který má ve svých d orbitálech více elektronů než titan. Jeho elektronová konfigurace je [Ar] 3d64 sdva.
Kdyby nebylo Hundova pravidla a Pauliho vylučovacího principu, nevěděli bychom, jak uspořádat těchto šest elektronů na jejich pět d orbitalů..
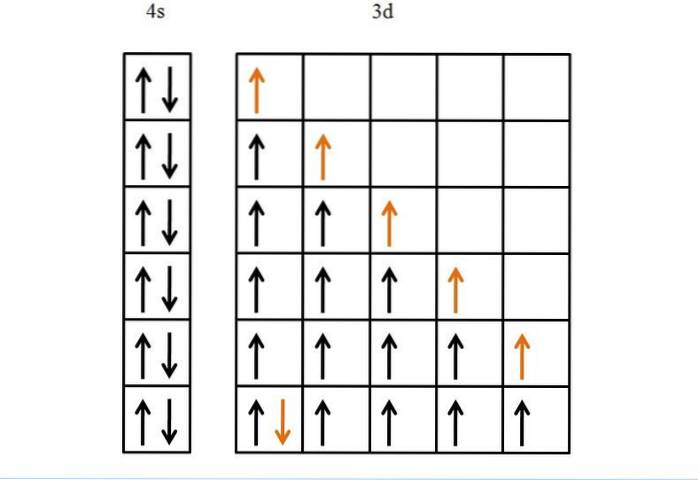
I když se to může zdát snadné, bez těchto pravidel by mohlo vzniknout mnoho nesprávných možností, pokud jde o pořadí vyplňování orbitalů.
Díky nim je postup zlatého šípu logický a monotónní, což není nic jiného než poslední elektron, který má být umístěn na orbitaly..
Reference
- Serway & Jewett. (2009). Fyzika: pro vědu a techniku s moderní fyzikou. Svazek 2. (Sedmé vydání). Cengage Learning.
- Glasstone. (1970). Učebnice fyzikální chemie. v Chemická kinetika. Druhé vydání. D. Van Nostrand, Company, Inc..
- Méndez A. (21. března 2012). Hundovo pravidlo. Obnoveno z: quimica.laguia2000.com
- Wikipedia. (2018). Hundovo pravidlo maximální multiplicity. Obnoveno z: en.wikipedia.org
- Chemistry LibreTexts. (23. srpna 2017). Hundova pravidla. Obnoveno z: chem.libretexts.org
- Nave R. (2016). Hundova pravidla. Obnoveno z: hyperphysics.phy-astr.gsu.edu



Zatím žádné komentáře