
Proces solvatace, rozdíly s hydratací a příklady

The solvatace je fyzikální a chemická vazba mezi solutem a částicemi rozpouštědla v roztoku. Od konceptu rozpustnosti se liší tím, že mezi pevnou látkou a jejími rozpuštěnými částicemi neexistuje termodynamická rovnováha..
Toto spojení je odpovědné za „zmizení“ rozpuštěných pevných látek z pohledu diváků; když ve skutečnosti jsou částice velmi malé a skončí „pokryty“ vrstvami molekul rozpouštědla, což znemožňuje jejich pozorování.
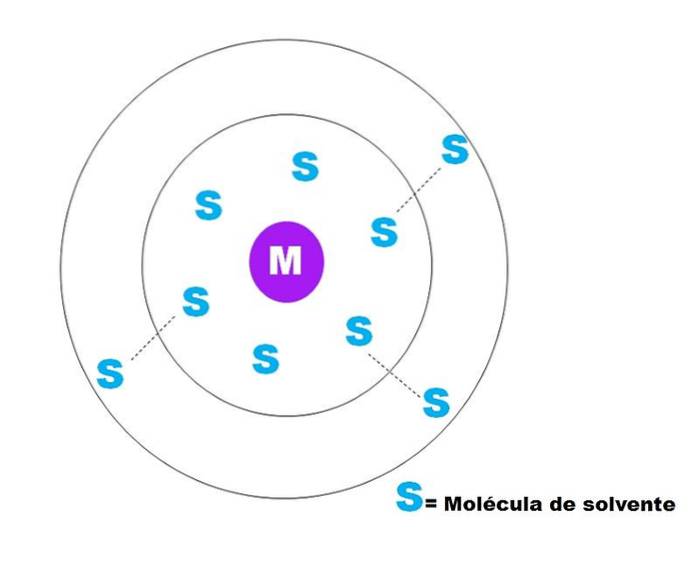
Na obrázku výše je znázorněna velmi obecná skica solvatace částice M. M může být také iont (M+) nebo molekula; a S je molekula rozpouštědla, kterou může být jakákoli sloučenina v kapalném stavu (i když může být také plynná).
Všimněte si, že M je obklopeno šesti molekulami S, které tvoří to, co je známé jako sféra primárního solvatace. Jiné molekuly S ve větší vzdálenosti interagují Van der Waalsovými silami s prvními a vytvářejí sféru sekundárního solvatace atd., Dokud není patrné nějaké třídění..
Rejstřík článků
- 1 Proces řešení
- 2 Energetické aspekty
- 3 Intermolekulární interakce
- 4 Rozdíly s hydratací
- 5 příkladů
- 5.1 Chlorid vápenatý
- 5.2 Močovina
- 5.3 Dusičnan amonný
- 6 Reference
Proces řešení
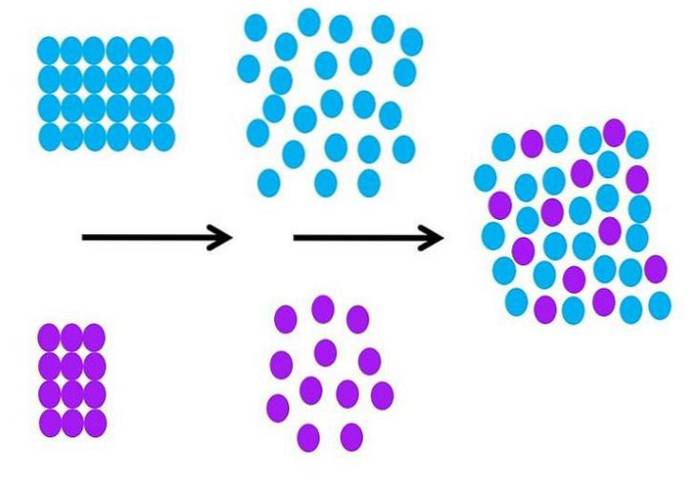
Jak molekulárně probíhá proces solvatace? Obrázek výše shrnuje nezbytné kroky.
Molekuly rozpouštědla, které mají modrou barvu, jsou zpočátku uspořádány a všechny vzájemně interagují (S-S); a fialové solutované částice (ionty nebo molekuly) dělají totéž se silnými nebo slabými interakcemi M-M.
Aby mohlo dojít k solvataci, musí se rozpouštět jak rozpouštědlo, tak rozpuštěná látka (druhá černá šipka), aby umožnily interakce rozpuštěné látky a rozpouštědla (M-S)..
To nutně znamená snížení interakcí solute-solute a rozpouštědlo-rozpouštědlo; pokles, který vyžaduje energii, a proto je tento první krok endotermický.
Jakmile se rozpuštěná látka a rozpouštědlo molekulárně rozšíří, obě se promíchají a vymění místa v prostoru. Každý fialový kruh na druhém obrázku lze porovnat s kruhem na prvním obrázku.
Na obrázku může být podrobně uvedena změna stupně uspořádání částic; objednal na začátku a neuspořádaný na konci. V důsledku toho je poslední krok exotermický, protože tvorba nových interakcí M-S stabilizuje všechny částice v roztoku..
Energetické aspekty
Za procesem solvatace je třeba vzít v úvahu mnoho energetických aspektů. Za prvé: interakce S-S, M-M a M-S.
Když jsou interakce M-S, tj. Mezi solutem a rozpouštědlem, mnohem vyšší (silné a stabilní) ve srovnání s interakcemi jednotlivých složek, hovoříme o exotermickém solvatačním procesu; a proto se do média uvolňuje energie, což lze ověřit měřením zvýšení teploty pomocí teploměru.
Pokud jsou naopak interakce M-M a S-S silnější než interakce M-S, pak k „rozšíření“ budou potřebovat více energie, než získají, jakmile je solvatace dokončena..
Mluví se tedy o endotermickém solvatačním procesu. V takovém případě se zaznamená pokles teploty nebo se ochladí okolí.
Existují dva základní faktory, které určují, zda se rozpuštěná látka rozpouští v rozpouštědle. První je změna entalpie roztoku (ΔHdis), jak bylo právě vysvětleno, a druhou je změna entropie (ΔS) mezi rozpuštěnou látkou a rozpuštěnou rozpuštěnou látkou. Obecně platí, že ΔS je spojen se zvýšením poruchy také zmíněným výše.
Intermolekulární interakce
Bylo zmíněno, že solvatace je výsledkem fyzikální a chemické vazby mezi solutem a rozpouštědlem; Jak přesně jsou však tyto interakce nebo odbory?
Pokud je solutem ion, M+, dochází k takzvaným interakcím iontů a dipólů (M.+-S); a pokud se jedná o molekulu, pak dojde k interakcím dipól-dipól nebo k Londonovým rozptylovým silám.
Když mluvíme o interakcích dipól-dipól, říká se, že v M a S existuje trvalý dipólový moment. Oblast M bohatá na δ - elektrony tedy interaguje s oblastí δ + elektronově chudou S. Výsledek všech těchto interakcí je tvorba několika solvatačních koulí kolem M.
Kromě toho existuje další typ interakce: koordinační. Zde molekuly S vytvářejí koordinační (nebo dativní) vazby s M a vytvářejí různé geometrie.
Základní pravidlo pro zapamatování a předpovídání afinity mezi rozpuštěnou látkou a rozpouštědlem je: rovný rozpouští rovný. Polární látky se proto velmi snadno rozpouštějí ve stejně polárních rozpouštědlech; a nepolární látky se rozpustí v nepolárních rozpouštědlech.
Rozdíly s hydratací
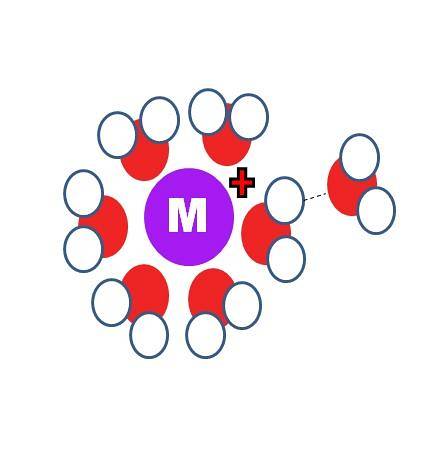
Jak se solvatace liší od hydratace? Dva identické procesy, kromě toho, že molekuly S jsou na prvním obrázku nahrazeny procesy vody, H-O-H.
Na horním obrázku vidíte kation M.+ obklopen šesti molekulami H.dvaO. Všimněte si, že atomy kyslíku (červené barvy) směřují ke kladnému náboji, protože je nejvíce elektronegativní, a proto má nejvyšší zápornou hustotu δ-.
Za první hydratační sférou jsou další molekuly vody seskupeny vodíkovými vazbami (OHdva-Achdva). Jedná se o interakce iontů a dipólů. Molekuly vody však mohou také vytvářet koordinační vazby s pozitivním centrem, zejména pokud je kovové..
Tak, slavné aquacomplexes, M (OHdva)n. Protože n = 6 na obrázku, šest molekul je orientováno kolem M v koordinačním osmistěnu (vnitřní sféře hydratace). V závislosti na velikosti M.+, velikost jeho náboje a jeho elektronická dostupnost, tato koule může být menší nebo větší.
Voda je možná nejpřekvapivějším rozpouštědlem ze všech: rozpouští neměřitelné množství rozpuštěných látek, je příliš polárním rozpouštědlem a má abnormálně vysokou dielektrickou konstantu (78,5 K).
Příklady
Níže jsou uvedeny tři příklady solvatace ve vodě.
Chlorid vápenatý
Rozpuštěním chloridu vápenatého ve vodě se uvolňuje teplo, když se solí kationů Cadva+ a Cl anionty-. Ca.dva+ obklopuje se počtem molekul vody rovným nebo větším než šest (Cadva+-Achdva).
Podobně Cl- je obklopen atomy vodíku, oblast δ + vody (Cl--HdvaNEBO). Uvolněné teplo lze použít k roztavení ledových hmot.
Močovina
V případě močoviny je to organická molekula se strukturou HdvaN-CO-NHdva. Při solvataci molekuly HdvaNebo vytváří vodíkové vazby se dvěma aminoskupinami (-NHdva-Achdva) a s karbonylovou skupinou (C = O-HdvaNEBO). Tyto interakce jsou odpovědné za jeho velkou rozpustnost ve vodě..
Stejně tak je jeho rozpouštění endotermní, to znamená, že ochlazuje nádobu na vodu, kde je přidána.
Dusičnan amonný
Dusičnan amonný, stejně jako močovina, je solut, který po solvataci jeho iontů roztok ochladí. NH4+ je solvatován podobným způsobem jako Cadva+, i když pravděpodobně proto, že má čtyřboká geometrie, má méně molekul HdvaNebo kolem vás; a NO3- je solvatován stejným způsobem jako anionty Cl- (ACHdva-NEBOdvaNE - HdvaNEBO).
Reference
- Glasstone S. (1970). Pojednání o chemii a fyzice. Aguilar, S.A., Madrid, Španělsko.
- Whitten, Davis, Peck a Stanley. Chemie. (8. vydání). Učení CENGAGE.
- Ira N. Levine. (2014). Principy fyzikochemie. Šesté vydání. Mc Graw Hill.
- Slovník Chemicool. (2017). Definice Solvation. Obnoveno z: chemicool.com
- Belford R. (s.f.). Procesy řešení. Chemistry LibreTexts. Obnoveno z: chem.libretexts.org
- Wikipedia. (2018). Řešení. Obnoveno z: en.wikipedia.org
- Hardinger A. Steven. (2017). Ilustrovaný glosář organické chemie: Solvation. Obnoveno z: chem.ucla.edu
- Surfujte Guppy. (s.f.). Proces řešení. Obnoveno z: surfguppy.com



Zatím žádné komentáře