
Struktura, vlastnosti a použití sulfidu stříbrného (Ag2S)
The sulfid stříbrný je anorganická sloučenina, jejíž chemický vzorec je AgdvaS. Skládá se z šedočerné pevné látky tvořené kationty Ag+ a S aniontydva- v poměru 2: 1. Sdva- je velmi podobný Ag+, protože oba jsou měkké ionty a dokáží se navzájem stabilizovat.
Stříbrné ozdoby mají tendenci tmavnout a ztrácejí svůj charakteristický lesk. Změna barvy není výsledkem oxidace stříbra, ale jeho reakce se sirovodíkem přítomným v prostředí v nízkých koncentracích; to může pocházet z hniloby nebo degradace rostlin, zvířat nebo potravin bohatých na síru.

HdvaS, jehož molekula nese atom síry, reaguje se stříbrem podle následující chemické rovnice: 2Ag (s) + HdvaS (g) => AgdvaS (s) + Hdva(G)
Proto AgdvaS je zodpovědný za černé vrstvy vytvořené na stříbře. V přírodě se však tento sulfid nachází také v minerálech Acantite a Argentite. Tyto dva minerály se od mnoha odlišují svými lesklými černými krystaly, jako je ten v pevné látce na obrázku výše..
AGdvaS má polymorfní struktury, atraktivní elektronické a optoelektronické vlastnosti, je polovodič a slibuje, že bude materiálem pro výrobu fotovoltaických zařízení, jako jsou solární články..
Rejstřík článků
- 1 Struktura
- 2 Vlastnosti
- 2.1 Molekulová hmotnost
- 2.2 Vzhled
- 2.3 Zápach
- 2.4 Teplota tání
- 2.5 Rozpustnost
- 2.6 Struktura
- 2.7 Index lomu
- 2.8 Dielektrická konstanta
- 2.9 Elektronika
- 2.10 Redukční reakce
- 3 Názvosloví
- 3.1 Systematika
- 3.2 Sklad
- 3.3 Tradiční
- 4 použití
- 5 Reference
Struktura
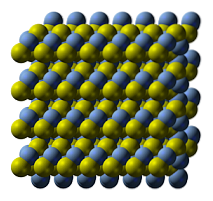
Horní obrázek ilustruje krystalovou strukturu sulfidu stříbrného. Modré koule odpovídají kationům Ag+, zatímco žluté na S aniontydva-. AGdvaS je polymorfní, což znamená, že za určitých teplotních podmínek může přijímat různé krystalové systémy..
Jak? Prostřednictvím fázového přechodu. Ionty jsou přeskupeny tak, aby zvýšení teploty a vibrace pevné látky nenarušily rovnováhu elektrostatické přitažlivosti a odpuzování. Když k tomu dojde, říká se, že dochází k fázovému přechodu, a pevná látka proto vykazuje nové fyzikální vlastnosti (jako je lesk a barva)..
AGdvaS za normálních teplot (pod 179 ° C) má monoklinickou krystalickou strukturu (α-AgdvaS). Kromě této pevné fáze existují ještě další dvě: bcc (kubický střed na těle) mezi 179 až 586 ° C a fcc (kubický centrovaný na tvářích) při velmi vysokých teplotách (δ-AgdvaS).
Minerál argentit se skládá z fcc fáze, známé také jako β-AgdvaS. Jakmile se ochladí a transformuje na akantit, jeho strukturální vlastnosti převládají v kombinaci. Proto obě krystalické struktury koexistují: monoklinická a bcc. Proto se objevují černé pevné látky s jasným a zajímavým podtextem..
Vlastnosti
Molekulární váha
247,80 g / mol
Vzhled
Šedavě černé krystaly
Zápach
Toaleta.
Bod tání
836 ° C Tato hodnota souhlasí se skutečností, že AgdvaS je sloučenina s malým iontovým charakterem, a proto se taví při teplotách pod 1000 ° C.
Rozpustnost
Ve vodě pouze 6,21 ∙ 10-patnáct g / l při 25 ° C To znamená, že množství černé pevné látky, která je solubilizována, je zanedbatelné. To je opět způsobeno nízkým polárním charakterem vazby Ag-S, kde není významný rozdíl v elektronegativitě mezi dvěma atomy..
Také AgdvaS je nerozpustný ve všech rozpouštědlech. Žádná molekula nedokáže účinně oddělit své krystalické vrstvy na ionty Ag+ a S.dva- solvatovaný.
Struktura
Na obrázku struktury také vidíte čtyři vrstvy vazeb S-Ag-S, které se pohybují přes sebe, když je těleso vystaveno kompresi. Toto chování znamená, že i když je polovodič, je tvárný jako mnoho kovů při pokojové teplotě..
Vrstvy S-Ag-S zapadají správně díky svým úhlovým geometriím, které jsou považovány za klikaté. Jelikož existuje kompresní síla, pohybují se po ose posunu, což způsobuje nové nekovalentní interakce mezi atomy stříbra a síry..
Index lomu
2.2
Dielektrická konstanta
6
Elektronický
AGdvaS je amfoterní polovodič, to znamená, že se chová, jako by byl typu n a typu p. Kromě toho není křehký, a proto byl studován pro jeho použití v elektronických zařízeních..
Redukční reakce
AGdvaS lze snížit na kovové stříbro koupáním černých kousků s horkou vodou, NaOH, hliníkem a solí. Proběhne následující reakce:
3AgdvaS (s) + 2Al (s) + 3HdvaO (l) => 6Ag (s) + 3HdvaS (ac) + AldvaNEBO3(s)
Nomenklatura
Stříbro, jehož elektronová konfigurace je [Kr] 4d105 s1, může ztratit pouze jeden elektron: nejvzdálenější oběžnou dráhu 5 s. To znamená, že kation Ag+ je ponechána elektronová konfigurace [Kr] 4d10. Proto má jedinečnou valenci +1, která určuje, jak by se jeho sloučeniny měly nazývat..
Síra má naproti tomu elektronickou konfiguraci [Ne] 3sdva3p4, a dokončení dvou valenčních oktetů vyžaduje dva elektrony. Když získá tyto dva elektrony (ze stříbra), transformuje se na sulfidový anion, Sdva-, s nastavením [Ar]. To znamená, že je izoelektronický pro argon z ušlechtilého plynu.
Takže AgdvaS musí být voláno podle následujících nomenklatur:
Systematický
Opicesulfid z dalstříbrný. Zde se uvažuje počet atomů každého prvku a jsou označeny předponami řeckých čitatelů.
Skladem
Sulfid stříbrný. Protože má jedinečnou valenci +1, není v závorkách uveden římskými číslicemi: sulfid stříbrný; což je špatně.
Tradiční
Sulfid stříbrnýico. Protože stříbro „pracuje“ s valencí +1, je k jeho názvu přidána přípona -ico. argentum V latině.
Aplikace
Některá z nových použití pro AgdvaS jsou následující:
-Koloidní roztoky jejích nanočástic (různých velikostí), mají antibakteriální aktivitu, nejsou toxické, a proto je lze použít v oblasti medicíny a biologie..
-Jeho nanočástice mohou tvořit takzvané kvantové tečky. Absorbují a emitují záření s větší intenzitou než mnoho fluorescenčních organických molekul, takže je mohou nahradit biologickými markery.
-Struktury α-AgdvaZpůsobují, že vykazuje nápadné elektronické vlastnosti, které se používají jako solární články. Stejně tak představuje výchozí bod pro syntézu nových termoelektrických materiálů a senzorů..
Reference
- Mark Peplow. (17. dubna 2018). Polovodičový sirník stříbrný se táhne jako kov. Převzato z: cen.acs.org
- Spolupráce: Autoři a redaktoři svazků III / 17E-17F-41C () krystalová struktura sulfidu stříbrného (Ag2S). In: Madelung O., Rössler U., Schulz M. (eds) Non-Tetrahedrally Bonded Elements and Binary Compounds I. Landolt-Börnstein - Group III Condensed Matter (Numerical Data and Functional Relationships in Science and Technology), vol 41C. Springer, Berlín, Heidelberg.
- Wikipedia. (2018). Sulfid stříbrný. Převzato z: en.wikipedia.org
- Stanislav I. Sadovnikov a plk. (Červenec 2016). AgdvaNanočástice a koloidní roztoky sulfidu stříbrného: Syntéza a vlastnosti. Převzato z: sciencedirect.com
- Azo materiály. (2018). Sulfid stříbrný (AgdvaS) Polovodiče. Převzato z: azom.com
- A. Nwofe. (2015). Vyhlídky a výzvy tenkých vrstev sulfidu stříbrného: Přehled. Oddělení vědy o materiálech a obnovitelné energie, Katedra průmyslové fyziky, Ebonyi State University, Abakaliki, Nigérie.
- UMassAmherst. (2011). Demonstrace přednášek: čištění poškozeného stříbra. Převzato z: lecturedemos.chem.umass.edu
- Studie. (2018). Co je sulfid stříbrný? - Chemický vzorec a použití. Převzato z: study.com



Zatím žádné komentáře