
Sulfid sodný vzorce, použití, rizika
The sulfid sodný (Na2S) je žlutá až cihlově červená krystalická pevná látka. V přírodě se vyskytuje v různých stupních hydratace, nejčastější je nonahydrát sulfidu sodného (Na2S 9H2O).
Jsou to ve vodě rozpustné soli, které poskytují silně zásadité roztoky. Když jsou vystaveny vlhkému vzduchu, absorbují vlhkost ze vzduchu, jsou schopny se spontánně zahřívat a způsobit vznícení blízkých hořlavých materiálů. Podobně při kontaktu s vlhkým vzduchem emitují sirovodík, který voní jako shnilá vejce..

Jsou to silná redukční činidla. Tyto látky mohou být nebezpečné pro životní prostředí, zejména pro vodní organismy.
Monosulfid sodný je komerčně dodáván ve formě vloček obsahujících 60-62% NadvaS ...
- Vzorce

- CAS: 1313-82-2 sulfid sodný (bezvodý)
- CAS: 1313-84-4 sulfid sodný (nehydrát)
2D struktura
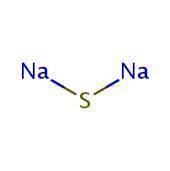
3D struktura

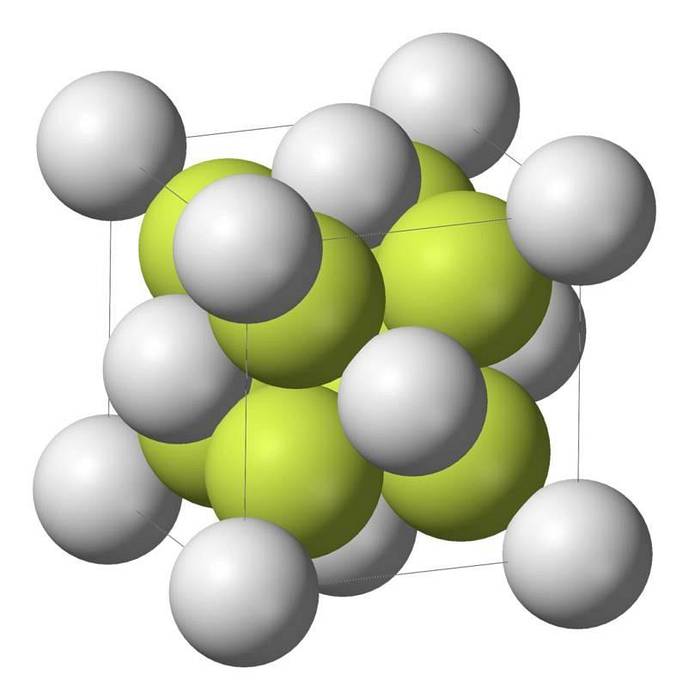
Vlastnosti sulfidu sodného
Fyzikální a chemické vlastnosti

Monosulfid sodný (Na2S) krystalizuje s antifluoritovou strukturou, ve které je každý atom S obklopen krychlí 8 atomů Na a každý atom Na čtyřstěnem se 4 atomy S..
Hořlavost
Jediným vysoce hořlavým členem anorganické sulfidové skupiny je sirovodík. Některé jiné anorganické sulfidy, například sulfid sodný, se však mohou při zahřátí samovolně zahřát a dokonce i vznítit..
Při vystavení ohni uvolňuje sulfid sodný plyny nebo páry oxidu siřičitého, které jsou dráždivé nebo toxické.
Reaktivita
- Anorganické sulfidy jsou obecně bazické (některé jsou silně bazické, a proto nekompatibilní s kyselinami).
- Mnohé z těchto sloučenin jsou redukční činidla (intenzivně reagují s oxidačními látkami).
- Jednoduché sulfidové soli (jako je sodík, draslík a sulfid amonný) intenzivně reagují s kyselinami a uvolňují vysoce toxický a hořlavý plynný sirovodík..
- Sulfid sodný je hořlavý. Při rychlém zahřátí nebo nárazu může explodovat.
- Při zahřátí na rozklad vydává toxické výpary oxidu sodného a oxidů síry.
- Prudce reaguje s uhlíkem, aktivním uhlím, diazoniovými solemi, N, N-dichlormethylaminem, silnými oxidanty a vodou.
Toxicita
Mnoho členů skupiny anorganických sulfidů se chová jako silné zásady a při kontaktu s pokožkou mohou způsobit vážné popáleniny..
Tato vlastnost závisí na její rozpustnosti. Nerozpustnější anorganické sulfidy (například sulfid rtuťnatý a sulfid kademnatý) nejsou žíravé.
Sulfid sodný má střední rozdělovací koeficient oktanol / voda (Pow) (-3,5). Tato hodnota se používá jako míra rozpustnosti (a biokoncentrace) látky v tukových tkáních zvířat (zejména vodních živočichů)..
Sulfid sodný je považován za nebezpečný pro životní prostředí, zejména pro vodní organismy.
Aplikace
V domácnosti se sulfid sodný používá v čističích odtoků, čisticích prostředcích pro domácnost (do trouby, koupelny), žehličkách na vlasy, mýdlech na myčky nádobí a automobilových airbagech..
V průmyslu se používá v čisticích prostředcích, v cementu a jako předzvěst při výrobě dalších chemikálií.
Klinické účinky
Vystavení sulfidu sodíku je běžné v rozvinutých a zaostalých zemích, a to jak v průmyslu, tak doma. Tyto korozivní látky jsou přítomny v různých výrobcích pro domácnost v nízkých koncentracích..
V rozvinutých zemích jsou závažné účinky vzácné. K nim dochází primárně z úmyslného požití chemické látky u dospělých. V rozvojových zemích jsou však závažné účinky častější.
Alkalické žíraviny způsobují nekrózu zkapalňování. Zmýdelňují tuky v buněčné membráně, ničí buňku a umožňují hluboký průnik do tkáně sliznice.
Orální expozice
Počáteční zánět se vyskytuje v gastrointestinální tkáni, následuje nekróza tkáně (s možnou perforací), poté granulace a nakonec vznik striktury.
U pacientů s mírným požitím se vyvine podráždění nebo popáleniny orofaryngu, jícnu nebo žaludku (povrchová hyperemie a edém)..
U pacientů se středně těžkou intoxikací se mohou objevit popáleniny stupně II (povrchové puchýře, eroze a ulcerace) s možnou následnou tvorbou zúžení (zejména jícnu)..
U některých pacientů (zejména u malých dětí) se může objevit edém horních cest dýchacích.
U pacientů s těžkou intoxikací požitím se mohou vyvinout hluboké popáleniny a nekróza gastrointestinální sliznice s komplikacemi, jako jsou: perforace (jícnu, žaludku, zřídka duodenální), tvorba píštělí (tracheoezofageální, aortoezofageální) a gastrointestinální krvácení..
Může se vyvinout: hypotenze, tachykardie, tachypnoe, tvorba striktur (hlavně jícnu), karcinom jícnu a edém horních cest dýchacích (který je běžný a často život ohrožující).
Těžká intoxikace je obecně omezena na úmyslné požití u dospělých.
Expozice vdechováním
Mírná expozice může způsobit kašel a bronchospazmus.
Těžké vdechování může způsobit edém horních cest dýchacích, popáleniny, stridor a vzácně i akutní poranění plic..
Oční expozice
Může způsobit závažné podráždění a chemózu spojivek, defekty epitelu rohovky, limbickou ischemii, trvalou ztrátu zraku a ve vážných případech perforace.
Dermální expozice
Mírná expozice způsobuje podráždění a popáleniny částečné tloušťky. U pacientů s těžkými popáleninami nebo šokem se může vyvinout metabolická acidóza..
Dlouhodobá expozice nebo produkty s vysokou koncentrací mohou způsobit popáleniny v plné tloušťce.
Bezpečnost a rizika
Standardní věty o nebezpečnosti globálně harmonizovaného systému klasifikace a označování chemických látek (GHS)
Globálně harmonizovaný systém klasifikace a označování chemických látek (GHS) je mezinárodně schválený systém vytvořený Organizací spojených národů a navržený tak, aby nahradil různé standardy klasifikace a označování používané v různých zemích pomocí globálních konzistentních kritérií..
Třídy nebezpečnosti (a jejich odpovídající kapitola GHS), standardy klasifikace a označování a doporučení pro sulfid sodný jsou následující (Evropská chemická agentura, 2017; OSN, 2015; PubChem, 2017):







Reference
- Benjah-bmm27, (2006). Fluorit-unit-cell-3D-ionic [obrázek] Obnoveno z: wikipedia.org.
- ChemIDplus, (2017). 1313-82-2 [obrázek] Obnoveno z: chem.nlm.nih.gov.
- ChemIDplus, (2017). 3D struktura 1313-82-2 - Sulfid sodný [obrázek] Obnoveno z: chem.nlm.nih.gov.
- ChemIDplus, (2017). 3D struktura 1313-84-4 - Sulfid sodný [obrázek] Obnoveno z: chem.nlm.nih.gov.
- Evropská agentura pro chemické látky (ECHA). (2017). Souhrn klasifikace a značení.
- Harmonizovaná klasifikace - příloha VI nařízení (ES) č. 1272/2008 (nařízení CLP). Sulfid sodný. Citováno dne 16. ledna 2017 z: echa.europa.eu.
- Evropská agentura pro chemické látky (ECHA). (2017). Souhrn klasifikace a značení.
- Oznámená klasifikace a označení. Sulfid sodný, hydratovaný. Citováno dne 16. ledna 2017 z: echa.europa.eu.
- Databáze nebezpečných látek (HSDB). TOXNET. (2017). Sulfid sodný. Bethesda, MD, EU: National Library of Medicine. Obnoveno z: toxnet.nlm.nih.gov.
- Lange, L. a Triebel, W. (2000). Sulfidy, polysulfidy a sulfany. V Ullmannově encyklopedii průmyslové chemie. Wiley-VCH Verlag GmbH & Co. KGaA. Obnoveno z dx.doi.org.
- Organizace spojených národů (2015). Globálně harmonizovaný systém klasifikace a označování chemických látek (GHS), šesté přepracované vydání. New York, EU: Publikace OSN. Obnoveno z: unece.org.
- Národní centrum pro biotechnologické informace. Složená databáze PubChem. (2016). Enneahydrát sulfidu sodného - struktura PubChem [obrázek] Citováno z: pubchem.ncbi.nlm.nih.gov.
- Národní centrum pro biotechnologické informace. Složená databáze PubChem. (2017). Monosulfid sodný. Bethesda, MD, EU: National Library of Medicine. Obnoveno z: pubchem.ncbi.nlm.nih.gov.
- Národní centrum pro biotechnologické informace. Složená databáze PubChem. (2017). Enneahydrát sulfidu sodného. Bethesda, MD, EU: National Library of Medicine. Obnoveno z: pubchem.ncbi.nlm.nih.gov.
- Národní úřad pro oceán a atmosféru (NOAA). CAMEO Chemicals. (2017). Chemický datový list. Bezvodý sulfid sodný. Silver Spring, MD. EU; Obnoveno z: cameochemicals.noaa.gov.
- Národní úřad pro oceán a atmosféru (NOAA). CAMEO Chemicals. (2017). Datový list reaktivní skupiny. Sulfidy, anorganické. Silver Spring, MD. EU; Obnoveno z: cameochemicals.noaa.gov.
- Ondřej Mangl, (2007). Sulfid sodný - Na2S [obrázek] Obnoveno z: wikipedia.org.
- PubChem, (2016). Monosulfid sodný [obrázek] Obnoveno z: puchem.nlm.nih.gov.
- PubChem, (2016). Enneahydrát sulfidu sodného [obrázek] Obnoveno z: puchem.nlm.nih.gov.
- Wikipedia. (2017). Rozdělovací koeficient oktanol-voda. Citováno 17. ledna 2017 z: wikipedia.org.
- .


Zatím žádné komentáře