
Aromatické nukleofilní substituční efekty, příklady
The aromatická nukleofilní substituce (SNAr) je reakce, ke které dochází v organické chemii, která spočívá v vytěsnění dobře odstupující skupiny příchozím nukleofilem. Z hlediska mechanismu a elektronických aspektů jde o opačnou stranu elektrofilní aromatické substituce (SEAr).
Obecně je odstupující skupinou halogen, který vychází jako halogenidový anion X-. K této reakci může dojít, pouze pokud má aromatický kruh (většinou benzen) nedostatek elektronů; to znamená, pokud má substituční skupiny přitahující elektrony.

Horní obrázek nastiňuje to, co bylo řečeno v předchozím odstavci. Skupina elektronových atraktorů EWG (pro zkratku v angličtině: Skupina pro výběr elektronů), aktivuje aromatický kruh pro nukleofilní útok negativních druhů Nu-. Je vidět, že se vytváří meziprodukt (ve středu), ze kterého se halogenid X uvolňuje nebo vystupuje-.
Všimněte si, že jednoduše je X nahrazeno Nu v aromatickém kruhu. Tato reakce je velmi univerzální a nezbytná při syntéze nových léčiv i při studiích syntetické organické chemie..
Rejstřík článků
- 1 Obecné aspekty
- 1.1 Rozdíly s elektrofilní aromatickou substitucí
- 2 efekty
- 2.1 Z počtu substituentů
- 2.2 Z odstupující skupiny
- 3 Příklad
- 3.1 Závěrečný komentář
- 4 Odkazy
Obecné znaky
Aromatický kruh může být „nabitý“ nebo „vybitý“ elektronů v závislosti na tom, jaké jsou jeho substituenty (ty, které nahrazují původní vazbu CH).
Když tyto substituenty mohou darovat elektronovou hustotu kruhu, říká se, že ho obohacují elektrony; Pokud jsou naopak atraktory elektronové hustoty (výše zmíněný EWG), pak se říká, že ochuzují kruh elektronů.
V obou případech je kruh aktivován pro určitou aromatickou reakci, zatímco pro druhou je deaktivován..
Například se říká, že aromatický kruh bohatý na elektrony je aktivní pro elektrofilní aromatickou substituci; to znamená, že může darovat své elektrony elektrofilním druhům, např+. Nebude však darovat elektrony druhu Nu-, protože záporné poplatky by se navzájem odpuzovaly.
Nyní, pokud je prsten chudý na elektrony, nemá způsob, jak je dát druhu E.+ (SEAr se nevyskytuje); na druhou stranu má schopnost přijímat elektrony druhu Nu- (SNAr je vyvinut).
Rozdíly s aromatickou elektrofilní substitucí
Po vyjasnění obecných vstupních aspektů lze nyní uvést některé rozdíly mezi SNAr a SEAr:
- Aromatický kruh funguje jako elektrofil (nedostatek elektronů) a je napaden nukleofilem.
- Odstupující skupina X je substituovaná na kruhu; ne H+
- Carbocations nejsou tvořeny, ale zprostředkovatelé se záporným nábojem, který lze delokalizovat rezonancí
- Přítomnost více atraktorových skupin v kruhu urychluje substituci, místo aby ji zpomalila
- Nakonec tyto skupiny nemají žádné přímé účinky na to, kde (na kterém uhlíku) dojde k substituci. Substituce bude vždy probíhat na uhlíku připojeném k odstupující skupině X.
Poslední bod je také znázorněn na obrázku: vazba C-X se rozbije a vytvoří novou vazbu C-Nu.
Efekty upravit
Z počtu substituentů
Přirozeně, čím je prsten chudší na elektrony, tím rychlejší je rSNA a tím méně drastické jsou podmínky, za kterých může dojít. Zvažte následující příklad znázorněný na obrázku níže:
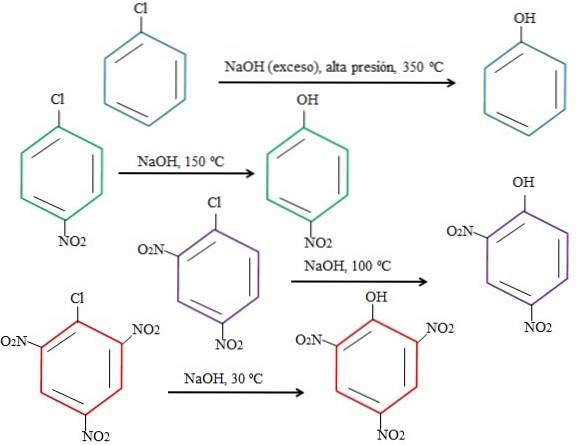
Pamatujte, že 4-nitrochlorbenzen (modrý kruh) vyžaduje drastické podmínky (vysoký tlak a teplota 350 ° C), aby mohlo dojít k nahrazení Cl OH. V tomto případě je chlór odstupující skupina (Cl-) a hydroxid nukleofil (OH.)-).
Když se objeví skupina NOdva, což je přitahovač elektronů (zelený kruh), lze substituci provádět při teplotě 150 ° C za tlaku okolí. Jak se zvyšuje počet skupin NOdva přítomné (fialové a červené kroužky), substituce probíhá při nižší a nižší teplotě (100 ° C, respektive 30 ° C).
Skupiny proto NEJSOUdva urychlit rSNA a zbavit kruh elektronů, čímž je náchylnější k útoku OH-.
Relativní polohy Cl vzhledem k NO zde nebudou vysvětleny.dva v 4-nitrochlorbenzenu a jak tyto mění rychlost reakce; Například reakční rychlosti 2-nitrochlorbenzenu a 3-nitrochlorbenzenu jsou různé, přičemž druhá je nejpomalejší ve srovnání s ostatními izomery.
Z odchozí skupiny
Při opětovném užívání 4-nitrochlorbenzenu je jeho substituční reakce ve srovnání s jeho fluorovaným protějškem pomalejší:
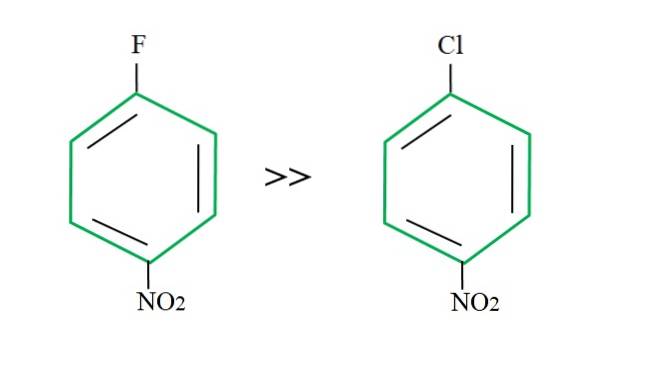
Vysvětlení nemůže spočívat v žádné jiné proměnné, než je rozdíl mezi F a Cl. Fluor je strašná odcházející skupina, protože vazba CF je těžší prolomit než vazba C-Cl. Rozbití této vazby tedy není určujícím krokem rychlosti pro SNAr, ale přidáním Nu- do aromatického kruhu.
Protože fluor je více elektronegativní než chlor, má atom uhlíku s ním spojený větší elektronický nedostatek (Cδ+-Fδ-). V důsledku toho je uhlík vazby C-F mnohem náchylnější k útoku Nu- než vazba C-Cl. Proto je substituce F za OH mnohem rychlejší než u Cl za OH.
Příklad
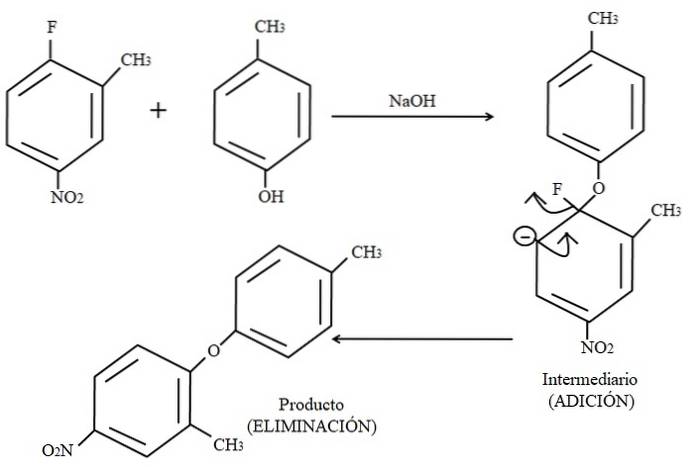
Nakonec je příklad tohoto typu organických reakcí uveden níže na obrázku výše. Parakresol se nejeví jako nukleofil; ale protože existuje zásadité médium, jeho skupina OH je deprotonována a ponechává ji jako anion fenoxidu, který napadá 2-methyl-4-nitrofluorbenzen.
Když k tomuto útoku dojde, říká se, že nukleofil se přidává k elektrofilu (aromatický kruh 2-methyl-4-nitrofluorbenzenu). Tento krok je vidět na pravé straně obrázku, kde je vytvořena meziproduktová sloučenina s oběma substituenty patřícími do kruhu.
Když se přidá para-kresol, objeví se záporný náboj, který se delokalizuje rezonancí v kruhu (všimněte si, že přestává být aromatický).
Na obrázku je zobrazena pouze poslední rezonanční struktura, ze které fluor končí jako F-; ale ve skutečnosti se uvedený negativní náboj delokalizuje i v atomech kyslíku skupiny NOdva. Po kroku přidávání přichází krok eliminace, poslední, kterým je, když se produkt konečně vytvoří.
Závěrečný komentář
Skupina čdva zbytek může být redukován na NH skupinudva, a odtud je možné provádět více reakcí syntézy za účelem modifikace konečné molekuly. To zdůrazňuje syntetický potenciál rSNA a jeho mechanismus také sestává ze dvou kroků: jednoho pro přidání a druhého pro eliminaci..
V současné době však existují experimentální a výpočetní důkazy o tom, že reakce ve skutečnosti probíhá podle koordinovaného mechanismu, kde oba kroky probíhají současně prostřednictvím aktivovaného komplexu, a nikoli meziproduktu..
Reference
- Morrison, R. T. a Boyd, R, N. (1987). Organická chemie. 5. vydání. Redakční Addison-Wesley Interamericana.
- Carey F. (2008). Organická chemie. (Šesté vydání). Mc Graw Hill.
- Graham Solomons T.W., Craig B.Fryhle. (2011). Organická chemie. Miny. (10. vydání.). Wiley plus.
- Wikipedia. (2019). Nukleofilní aromatická substituce. Obnoveno z: en.wikipedia.org
- James Ashenhurst. (06. září 2019). Nukleofilní aromatická substituce (NAS). Obnoveno z: masterorganicchemistry.com
- Chemistry LibreTexts. (5. června 2019). Nukleofilní aromatická substituce. Obnoveno z: chem.libretexts.org

Zatím žádné komentáře