
Vzorec oxidu uhličitého (PbO), vlastnosti, rizika a použití

The olovnice, Oxid olovnatý nebo oxid olovnatý je chemická sloučenina vzorce PbO. Vyskytuje se ve dvou polymorfech: litharge a masicotite. Jeho struktura je znázorněna na obrázku 1.
Vrátíme-li se ke složení, litharge je oxidovaný produkt roztaveného olova, který byl míchán nebo atomizován za účelem začlenění vzduchu, poté ochlazen a rozemlet za vzniku žlutého prášku..
Název masikotit se používá jak pro přírodní minerál, tak pro produkt oxidu uhelnatého vyráběného zahříváním uhličitanu olovnatého na 300 ° C (oxid olovnatý, 2016). Tyto minerály jsou zobrazeny na obrázku 2.

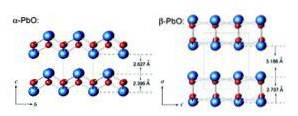
Masikotit má ortorombickou strukturu, zatímco litharge má tetragonální krystalovou strukturu. Oxid olovnatý (II) má schopnost měnit strukturu při zahřívání nebo chlazení. Tyto struktury jsou znázorněny na obrázku 3.
PbO se vyrábí oxidací kovového olova. Kov se roztaví za účelem výroby olověných tablet a poté se rozemele na 170 až 210 ° C a prochází oxidací při plamenech při teplotách nad 600 ° C. Oxidové produkty se drtí, aby se získal hotový oxid olovnatý (Kirk-Othmer, 1995).
2Pb + O2 → 2PbO
PbO se vyrábí ve velkém měřítku jako meziprodukt při rafinaci olověných rud na kovové olovo. Použitým olovnatým minerálem je galenit (olovnatý (II) sulfid). Při vysoké teplotě (1 000 ° C) se sulfid převádí na oxid následujícím způsobem:
2PbS + 3O2 → 2PbO + 2SO2
Rejstřík článků
- 1 Fyzikální a chemické vlastnosti olovnice
- 2 Reaktivita a nebezpečí
- 3 použití
- 4 Odkazy
Fyzikální a chemické vlastnosti oxidu plumbous
Oxid olovnatý může mít dvě různé podoby: jako žlutý suchý prášek s ortorombickou strukturou (masicotit) nebo jako načervenalé tetragonální krystaly (litharge). Oba způsoby jsou znázorněny na obrázku 4.

Sloučenina má molekulovou hmotnost 223,20 g / mol a hustotu 9,53 g / ml. Má teplotu tání 888 ° C a teplotu varu 1470 ° C (National Center for Biotechnology Information, S.F.).
Sloučenina je velmi špatně rozpustná ve vodě a je schopna rozpustit pouze 0,0504 gramu na litr při 25 ° C ve formě masikotitu a 0,1065 gramu na litr při 25 ° C ve formě litharge. Sloučenina je také nerozpustná v alkoholu. Je rozpustný v kyselině octové, zředěném HNO3 a zásadách (Royal Society of Chemistry, 2015).
Sloučenina je slabé oxidační nebo redukční činidlo, stále však mohou nastat redoxní reakce. Tyto sloučeniny nereagují na vodu.
Oxid olovnatý oxiduje při zahřátí karbid hliníku žhavením. Směsi oxidu olovnatého s hliníkovým prachem (jako u jiných kovů: sodík, zirkonium) způsobují prudký výbuch.
Reaktivita a nebezpečí
Oxid olovnatý je sloučenina klasifikovaná jako jedovatá. Látka je toxická pro centrální nervový systém a může být pro člověka karcinogenní (bezpečnostní list materiálu, oxid olovnatý, žlutý, 2013).
Příznakem časné otravy jsou olověné linie, které se objevují na okraji dásní a kůže zešedne. Neurastenický syndrom také vznikne v počátečním období envenomace..
Otrava mozečku může mít za následek depresi otravy olovem, mánii otravy olovem, toxicitu olova a citlivost na paralýzu neuritidy.
Otrava olovem může také způsobit hypochromní anémii a endokrinní a metabolické poruchy. Otrava olovem může navíc inhibovat aktivitu určitých enzymů v zažívacím systému a způsobit zažívací potíže, silné bolesti břicha a poškození jater. Může také způsobit vysoký krevní tlak a zvýšený cholesterol..
Pokud dojde k silné bolesti břicha, mohou být přijata některá opatření, jako je subkutánní injekce atropinu a jiných léků, horké břicho, klystýr, horká koupel atd. Maximální povolená koncentrace ve vzduchu je 0,01 mg / m3 (oxid olovnatý, 2016).
V případě kontaktu s očima nebo pokožkou je třeba ji umýt velkým množstvím vody. V případě vdechnutí nebo požití by měla být oběť odvezena na větrané místo. Zvracení by nemělo být vyvoláváno. Pokud oběť nedýchá, měla by být provedena resuscitace z úst do úst.
Ve všech případech je třeba vyhledat okamžitou lékařskou pomoc. Oxid olovnatý je škodlivá sloučenina pro životní prostředí, k bioakumulaci této chemické látky může docházet u rostlin a savců.
Důrazně se doporučuje, aby tato látka nevnikla do životního prostředí, proto s ní musí být zacházeno a skladováno v souladu se stanovenými ustanoveními (Národní institut pro bezpečnost a ochranu zdraví při práci, 2015)..
Aplikace
Oxid olovnatý byl používán jako sušička barev a jako nízký tok požáru při výrobě keramiky a skla. Olovnaté křišťálové sklo se používá při výrobě vysoce kvalitního stolního nádobí.
Při použití oxidu uhelnatého jako tavidla je možné získat sklo s vysokým indexem lomu a v důsledku toho s požadovaným jasem (British Encyclopedia, 2016).
Polokovové keramické vodiče mají nejvyšší vodivost ze všech keramických materiálů kromě supravodivých. Oxid olovnatý je příkladem tohoto typu polokovové keramiky. Tyto materiály mají překrývající se pásma elektronové energie a jsou proto vynikajícími elektronickými vodiči (Mason, 2008).
Oxid olovnatý se používá hlavně v elektronkách, obrazovkách, optickém skle, rentgenovém olovnatém skle a gumách odolných proti záření..
Používá se jako analytické činidlo, tok křemičitanu, ale také pro srážení aminokyselin
Oxid olovnatý se používá při výrobě stabilizátoru z plastu z PVC a je také surovinou pro další soli olova. Používá se také při rafinaci ropy a ke stanovení zlata a stříbra..
Používá se také jako žlutý pigment v barvách a smaltech. Masicotite používali jako pigment umělci od 15. do 18. století.
Tenké vrstvy oxidu olovnatého se používají k výrobě duhových barev v mosazi a bronzu. Litharge je smíchán s glycerolem za vzniku instalatérského cementu.
Reference
- Encyklopedie Britannica. (2016, 10. října). Sklenka. Obnoveno z britannica: britannica.com.
- Kirk-Othmer. (devatenáct devadesát pět). Encyclopedia of Chemical Technology. 4. vyd. Svazky 1. New York: John Wiley and Sons.
- Oxid olovnatý. (2016, 1. května). Obnoveno z cameo.mfa: cameo.mfa.org.
- Oxid olovnatý. (2016). Obnoveno z chemické knihy: chemicalbook.com.
- Mason, T. O. (2008, 12. března). Vodivá keramika. Obnoveno z britannica: britannica.com.
- Bezpečnostní list materiálu Oxid olovnatý, žlutý. (2013, 21. května). Obnoveno z sciencelab: sciencelab.com.
- Národní centrum pro biotechnologické informace. (S.F.). Složená databáze PubChem; CID = 14827. Obnoveno z PubChem: pubchem.ncbi.nlm.nih.gov.
- Národní institut pro bezpečnost a ochranu zdraví při práci. (2015, 22. července). OLEJ OLEJ (II). Obnoveno z cdc.gov: cdc.gov.
- Royal Society of Chemistry. (2015). Oxid olovnatý (II). Obnoveno z chemspider: chemspider.com.



Zatím žádné komentáře