
Struktura jodidu draselného (KI), vlastnosti, získávání, použití, rizika

The jodid draselný je anorganická sloučenina tvořená iontem draslíku (K.+) a jodidový ion (I.-). Jeho chemický vzorec je KI. Je to bílá krystalická pevná látka, iontové povahy a velmi dobře rozpustná ve vodě..
KI umožňuje provádět různé chemické reakce a analýzy a používá se k měření množství ozonu v atmosféře. Používá se také v infračervených (IR) analytických zařízeních.

Jodid draselný se přidává do běžné kuchyňské soli, aby se zabránilo nedostatku jódu u lidí, protože to může být vážný zdravotní problém.
Používá se jako expektorans, protože pomáhá hlenu snadno proudit z dýchacích cest ven. Používá se také k léčbě některých plísňových infekcí a používá se v některých kosmetických přípravcích.
Používají ho veterinární lékaři k léčbě zvířat podobných problémů, jaké mají lidé, jako je kašel a kožní infekce. Dokonce se přidává ve velmi malém množství do krmiva pro zvířata.
Rejstřík článků
- 1 Struktura
- 2 Názvosloví
- 3 Vlastnosti
- 3.1 Fyzický stav
- 3,2 Molekulová hmotnost
- 3.3 Teplota tání
- 3.4 Bod varu
- 3.5 Hustota
- 3.6 Rozpustnost
- 3,7 pH
- 3.8 Chemické vlastnosti
- 3.9 Další vlastnosti
- 4 Získání
- 5 použití
- 5.1 Při léčbě hypertyreózy
- 5.2 V jiných lékařských aplikacích
- 5.3 Ve veterinárních aplikacích
- 5.4 Při ochraně štítné žlázy v případě nouze
- 5.5 Při měření ozonu v atmosféře
- 5.6 V různých použitích
- 6 Rizika
- 7 Reference
Struktura
Jodid draselný je iontová sloučenina vytvořená draselným kationtem K.+ a jodidový anion I-, proto je mezi nimi vazba iontová. Oxidační stav draslíku je +1 a valence jodu je -1.
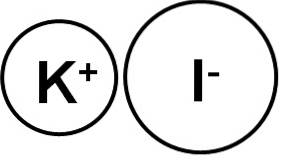
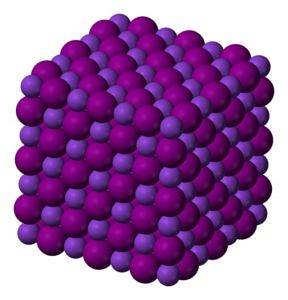
KI krystaly jodidu draselného jsou krychlové.
Nomenklatura
- Jodid draselný
- Jodid draselný
Vlastnosti
Fyzický stav
Bezbarvá až bílá krystalická pevná látka. Krychlové krystaly.
Molekulární váha
166,003 g / mol
Bod tání
681 ° C
Bod varu
1323 ° C
Hustota
3,13 g / cm3
Rozpustnost
Velmi dobře rozpustný ve vodě: 149 g / 100 g vody při 25 ° C. Mírně rozpustný v ethanolu a etheru.
pH
Jeho vodné roztoky jsou neutrální nebo zásadité, s pH mezi 7 a 9.
Chemické vlastnosti
Na vlhkém vzduchu mírně hygroskopický.
Je stabilní na suchém vzduchu. Světlo a vlhkost urychlují jeho rozklad a jeho barva se mění na žlutou v důsledku uvolňování malého množství jódu (I.dva) a jodičnany (IO3-).
Vodné roztoky KI také časem zežloutnou, ale trocha alkálie tomu může zabránit.
Tyto roztoky rozpouštějí jód (I.dva) dává KI3:
Já- + Jádva → já3-
Další vlastnosti
Má silně hořkou a slanou chuť. Není hořlavý.
Získávání
Jodid draselný lze získat zahřátím jódu (I.dva) v koncentrovaném roztoku hydroxidu draselného (KOH):
3 jádva + 6 KOH → 5 KI + KIO3 + HdvaNEBO
Výsledný roztok jodičnanu a jodidu se zahřívá k odstranění vody, zahustí se do sucha, přidá se dřevěné uhlí a zahřívá se na vysokou teplotu. Uhlí bere kyslík z jodičnanu a oxiduje na oxid uhličitý, čímž redukuje jodičnan na jodid:
2 KIO3 + C → 2 KI + 3 COdva
Získaný jodid draselný může být rekrystalizován pro čištění. To znamená, že se znovu rozpouští ve vodě a je znovu vyvolána krystalizace..
Aplikace
Při léčbě hypertyreózy
Jodid draselný slouží jako další léčba spolu s dalšími antityroidními látkami k léčbě hypertyreózy.
Hypertyreóza je onemocnění, které způsobuje, že štítná žláza produkuje příliš mnoho hormonu štítné žlázy, mimo jiné se zvětšenou štítnou žlázou, snížením hmotnosti, rychlým srdečním rytmem a podrážděností..
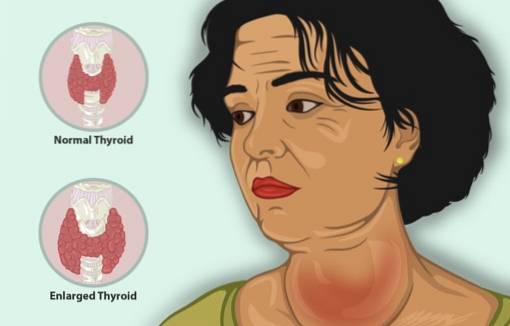
U pacientů s hypertyreózou KI rychle snižuje příznaky, protože inhibuje uvolňování hormonu štítné žlázy.
Jeho účinky na štítnou žlázu jsou: snížení počtu krevních cév v žláze, zpevnění jejích tkání a zmenšení velikosti jejích buněk.
Z tohoto důvodu se používá jako předoperační léčba k vyvolání involuce nebo zmenšení štítné žlázy před tyreoidektomií (odstranění štítné žlázy), protože to usnadňuje tuto operaci..
V jiných lékařských aplikacích
Jodid draselný má expektorační vlastnosti, protože zvyšuje sekreci dýchacích tekutin, což vede ke snížení viskozity hlenu..

Používá se k léčbě erythema nodosum, což je bolestivý otok nohou, ve kterém se tvoří červené uzliny, a zvýšení teploty.
Je to antifungální látka. Umožňuje léčbu sporotrichózy, což je kožní infekce způsobená plísní. Toto onemocnění se vyskytuje u lidí, kteří pracují s rostlinami a půdou, jako jsou zemědělci a zahradníci..
Používá se také k léčbě nedostatku jódu nebo k jeho prevenci, a proto se přidává do stolní soli nebo jedlé soli (chlorid sodný NaCl) jako zdroj jódu a někdy i v pitné vodě.
Ve veterinárních aplikacích
Jodid draselný se zvířatům podává jako antitusikum, ke zvýšení a zkapalnění tekutin v dýchacích cestách, při chronickém bronchiálním kašli, při revmatismu a jako protizánětlivý prostředek.
Používá se také k mykóze (houbovým infekcím) zvířat, ke zmírnění svědění a k chronické otravě olovem nebo rtutí.
Při ochraně štítné žlázy při radioaktivních mimořádných událostech
Jodid draselný má ochranné vlastnosti štítné žlázy v případě, že byla osoba vystavena jadernému záření.
KI zaplavuje štítnou žlázu neradioaktivním jódem, čímž blokuje absorpci radioaktivních molekul a absorpci radioaktivního jódu, čímž chrání štítnou žlázu před rakovinou, kterou může záření způsobit..
Při měření ozonu v atmosféře
Ozonový plyn (O.3) lze měřit v atmosféře pomocí elektrolytických článků zvaných ozonesondes, které jsou neseny radiosondovými balónky.
Tyto elektrolytické články obsahují KI roztok jodidu draselného. Buňky jsou zpočátku v chemické a elektrické rovnováze.
Když je vzorek vzduchu ozonu (O3) proniká do jedné z buněk, rovnováha je narušena, protože nastane následující reakce:
2 KI + O3 + HdvaO → jádva + NEBOdva + 2 KOH
Tato reakce produkuje elektrický proud, který proudí mezi buňkami..
Množství vyprodukovaného elektrického proudu je nepřetržitě přenášeno rádiovými vlnami na stanici na zemi. Tímto způsobem se získá ozonový profil od země do výšky koule..

V různých použitích
Jodid draselný také umožňuje:
- Eliminace volných radikálů, jako je hydroxylový radikál OH.
- Výroba fotografických emulzí k vysrážení stříbra.
- Vylepšujte krmivo pro zvířata přidáváním v malých množstvích.
- Odstraňte hnůj z hospodářských zvířat.
- Přenášejte světlo infračerveného spektra v infračerveném analytickém zařízení.
- Provádějte určité chemické reakce a analýzy v chemických laboratořích.
- Používejte jej ve výrobcích osobní hygieny.
- Proveďte analýzu znečištění životního prostředí.
Rizika
Někteří lidé citliví na jodidy by měli brát s opatrností, protože mohou způsobit jodismus nebo chronickou otravu jódem, například u pacientů s autoimunitní chorobou štítné žlázy..
Lidé s tuberkulózou nebo akutní bronchitidou by měli být také opatrní.
KI může způsobit změkčení slinných žláz, může spálit ústa nebo hrdlo, neobvyklé zvýšení slinění, bolest zubů a zánět dásní a kovovou chuť, mimo jiné příznaky..
Může také podráždit oči a otevřít rány na pokožce..
Reference
- NÁS. Národní lékařská knihovna. (2019). Jodid draselný. Obnoveno z pubchem.ncbi.nlm.nih.gov.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Čtvrté vydání. John Wiley & Sons.
- Dean, J.A. (editor). (1973). Lange's Handbook of Chemistry. Jedenácté vydání. McGraw-Hill Book Company.
- Valkovic, V. (2019). Dekontaminace po ozáření. Nejcitlivější části těla. In Radioactivity in the Environment (Second Edition). Obnoveno ze sciencedirect.com.
- Smit, H.G.J. (2015). Chemistry of the Atmosphere-Observations for Chemistry (In Situ). In Encyclopedia of Atmospheric Sciences (druhé vydání). Obnoveno ze sciencedirect.com.
- Muralikrishna, I.V. a Manickam, V. (2017). Analytické metody pro monitorování znečištění životního prostředí. V řízení životního prostředí. Obnoveno ze sciencedirect.com.
- Wallace, J.M. a Hobbs, P.V. (2006). Atmosférická chemie 1. Ve vědě o atmosféře (druhé vydání). Obnoveno ze sciencedirect.com.



Zatím žádné komentáře